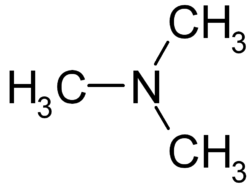
Trimethylamin
| Strukturformel | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||
| Allgemeines | |||||||||||||||||||||
| Name | Trimethylamin | ||||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||||
| Summenformel | C3H9N | ||||||||||||||||||||
| CAS-Nummer | 75-50-3 | ||||||||||||||||||||
| PubChem | 1146 | ||||||||||||||||||||
| Kurzbeschreibung |
farbloses, widerwärtig fisch- oder tranartig riechendes Gas[1] | ||||||||||||||||||||
| Eigenschaften | |||||||||||||||||||||
| Molare Masse | 59,11 g·mol−1 | ||||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||||
| Dichte | |||||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||||
| Siedepunkt |
2,9 °C[2] | ||||||||||||||||||||
| Dampfdruck | |||||||||||||||||||||
| Löslichkeit | |||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||
| |||||||||||||||||||||
| MAK |
2 ppm−3, 4,9 mg/m³[2] | ||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||
Trimethylamin ist ein farbloses brennbares Gas mit schon in starker Verdünnung intensivem fischartigen Geruch; in höheren Konzentrationen erinnert er stärker an den des chemisch nahe verwandten Ammoniaks. Es ist stark hygroskopisch, löst sich gut in Wasser und bildet darin eine recht starke Base. Es kommt als 40-prozentige wässrige Lösung, 33-prozentige Lösung in Ethanol und als druckverflüssigtes Gas in den Handel.
Gewinnung und Darstellung
Die großtechnische Herstellung von Trimethylamin erfolgt durch die Umsetzung von Methanol und Ammoniak bei Temperaturen von 370 bis 430 °C und Drücken von 20 bis 30 bar. Die Reaktion wird in der Gasphase an sauren Heterogenkatalysatoren auf der Basis von Silicium-Aluminium-Oxiden durchgeführt. Als Reaktionsprodukte entstehen neben Trimethylamin und Wasser noch Methylamin CH3NH2 und Dimethylamin (CH3)2NH:
Die Reinigung und Aufarbeitung des Reaktionsgemisches erfolgt durch mehrstufige Destillation unter Druck.
Mit reaktiveren Methylierungsmitteln wie Methyliodid oder Dimethylsulfat kann Ammoniak bei niedrigen Temperaturen methyliert werden. Allerdings erhält man auch hiermit Gemische der möglichen Methylierungsstufen einschließlich des quartären Tetramethylammoniumions.
Eigenschaften
Physikalische Eigenschaften
Bei Raumtemperatur ist Trimethylamin ein farbloses Gas. Es lässt sich durch Abkühlen oder Druckerhöhung verflüssigen. Trimethylamin ist gut löslich in Wasser und aliphatischen Alkoholen wie z.B. Methanol. Es hat einen unangenehmen, fisch- bzw. tran- bis ammoniakartigen Geruch, der schon bei Konzentrationen von 0,0005 - 4,2 mg/m³ wahrnehmbar ist.
Chemische Eigenschaften
Trimethylamin löst sich sehr leicht in Wasser, die Lösung reagiert als Base. Das Molekül dissoziiert in wässeriger Lösung nach:
Der höhere pKs-Wert (9,81) gegenüber z.B. Ammoniak (9,25) erklärt sich aus dem +I-Effekt der drei Methylgruppen. Die dennoch schwächere Basizität als die "Zwischenglieder" Methyl- und Dimethylamin (pKs 10,66 bzw. 10,73) lässt sich aus der sterischen Behinderung des freien Elektronenpaares am Stickstoffatom, das für die Basizität verantwortlich ist, erklären.
Trimethylamin ist, wie alle Amine, eine schwache Base. Mit Säuren bildet es ionisch aufgebaute Salze, aus denen es mit stärkeren Basen wieder freigesetzt werden kann.
Verwendung
Hauptfolgeprodukt von Trimethylamin ist Cholinchlorid, das durch Umsetzung von Ethylenoxid mit einer wässrigen Trimethylaminhydrochlorid-Salzlösung oder durch Umsetzung von Trimethylamin mit 2-Chlorethanol (Ethylenchlorhydrin) hergestellt werden kann. Außerdem findet Trimethylamin Anwendung bei der Herstellung von Wachstumsregulatoren, Ionentauscherharzen und als Katalysator in der organischen Synthese.
Vorkommen in der Natur
Als Metabolit des Cholin-Stoffwechsels lässt sich Trimethylamin in vielen Organismen nachweisen. Höhere Konzentrationen entstehen beim mikrobiellen Abbau von Trimethylamin-N-oxid, das vor allem in Seefischen reichlich vorhanden ist[6], beispielsweise durch Bakterien der Gattungen Pseudomonas und Shewanella. Intensiver Trimethylamin-Geruch ("Heringslake") ist deshalb ein sicheres Indiz für mangelnde Frische. Trimethylamin entsteht weiterhin im Vaginalsekret und zersetztem männlichen Ejakulat. Unter den Ständerpilzen sind Brandpilze wie der Steinbrand (Tilletia caries) in der Lage, Trimethylamin zu produzieren und bei Befall von Weizen die Getreidekörner zu verderben. Schließlich produzieren einige Pflanzen Trimethylamin, beispielsweise Stinkender Gänsefuß (Chenopodium vulvaria) und Wald-Bingelkraut (Mercurialis perennis). Auch in den Blüten von Esskastanie, Weißdorn, Birne, Eberesche und weiteren verwandten Rosengewächsen und in Berberitzen findet sich das Amin. Bei den letztgenannten dient es vermutlich der Anlockung von Käfern als Bestäuber-Insekten (Cantharophilie). Schließlich ist Trimethylamin in Bucheckern enthalten. Abgeleitet vom Gattungsnamen der Rotbuche (Fagus) wird der Stoff deshalb auch als Fagin bezeichnet. Durch Röstung der Früchte wird die Giftwirkung abgebaut.
Wirkung auf den menschlichen Körper
Trimethylamin gilt als schwach giftig. Es wirkt reizend auf Augen und Atmungsorgane. Bei Geruchswahrnehmung kann schon eine gesundheitsgefährdende Konzentration vorliegen. Beim Verschlucken können die Wirkungen von Erbrechen mit Bauchschmerzen bis zu Verätzungen führen. Verätzungen können bis hin zur Zerstörung von Haut, Augen, Atem- und Verdauungswegen führen.
Siehe auch
- Trimethylaminurie („Fischgeruch“-Syndrom)
Einzelnachweise
- ↑ 1,0 1,1 Jenny Hartmann-Schreier, in: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Eintrag zu CAS-Nr. 75-50-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30.12.2007 (JavaScript erforderlich)
- ↑ 3,0 3,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 75-50-3 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Datenblatt Trimethylamine bei Sigma-Aldrich, abgerufen am 24. April 2011.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Römpp CD 2006, Georg Thieme Verlag 2006