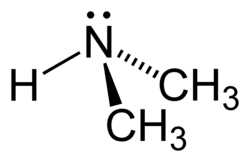
Dimethylamin
| Strukturformel | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||
| Allgemeines | |||||||||||||||||||||
| Name | Dimethylamin | ||||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||||
| Summenformel | C2H7N | ||||||||||||||||||||
| CAS-Nummer | 124-40-3 | ||||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit fischartigem Geruch[1] | ||||||||||||||||||||
| Eigenschaften | |||||||||||||||||||||
| Molare Masse | 45,08 g·mol−1 | ||||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||||
| Dichte |
0,67 g·cm−3 (beim Siedepunkt v. 7 °C) [1] | ||||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||||
| Siedepunkt |
7 °C [1] | ||||||||||||||||||||
| Dampfdruck | |||||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||
| |||||||||||||||||||||
| MAK |
2 ppm, 3,7 mg·m−3 [1] | ||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||
Dimethylamin ist ein farbloses, brennbares Gas mit intensivem Geruch. Es löst sich sehr gut in Wasser und bildet damit eine Base. Es kommt als wässrige Lösung und als druckverflüssigtes Gas in den Handel.
Gewinnung und Darstellung
Die großtechnische Herstellung von Dimethylamin erfolgt durch die Umsetzung von Methanol und Ammoniak bei Temperaturen von 370–430 °C und Drücken von 20–30 bar. Die Reaktion wird in der Gasphase an saueren Heterogenkatalysatoren auf der Basis von Silicium-Aluminium-Oxiden durchgeführt. Als Reaktionsprodukte entstehen neben Dimethylamin und Wasser noch Methylamin CH3NH2 und Trimethylamin (CH3)3N:
Die Reinigung und Aufarbeitung des Reaktionsgemisches erfolgt durch mehrstufige Destillation unter Druck.
Eigenschaften
Physikalische Eigenschaften
Bei Raumtemperatur ist Dimethylamin ein farbloses Gas. Es lässt sich durch Abkühlen oder Druckerhöhung verflüssigen. Dimethylamin ist sehr gut löslich in Wasser und Methanol. Es hat einen intensiven, fischartig ammoniakalischen Geruch.
Chemische Eigenschaften
Dimethylamin ist eine starke Base (pKs 10,73) und bildet mit Säuren daher Salze. Durch Umsetzung mit Alkylierungsmitteln, Alkylenoxiden, Carbonylverbindungen, organischer Säuren usw. kann Dimethylamin zu zahlreichen Folgeverbindungen umgesetzt werden.
Verwendung
Dimethylamin ist als meistverwendetes Methylamin Zwischenprodukt zur Herstellung zahlreicher Stoffe wie Lösungsmitteln, Pflanzenschutzmitteln, Vulkanisationschemikalien, Antioxidantien, Raketentreibstoffen, Dimethylglycin, quartären Ammoniumsalzen, Detergentien, Medikamenten und Farbstoffen. Im Labor dient es zur Einführung der Dimethylamino-gruppe. Es kommt als 40- bis 60%ige wässrige Lösung oder als druckverflüssigtes Gas in Gasflaschen in den Handel. Hauptfolgeprodukte sind Stoffe wie Dimethylformamid (DMF) und Dimethylacetamid (DMAc). Da Dimethylamin auch zur Herstellung von Giftgasen und zur Synthese von illegalen Drogen verwendet werden kann, unterliegt der Handel speziellen, gesetzlichen Beschränkungen.
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Eintrag zu CAS-Nr. 124-40-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. September 2007 (JavaScript erforderlich)
- ↑ 2,0 2,1 Thieme Chemistry (Hrsg.): Eintrag zu Dimethylamin im Römpp Online. Version 3.29. Georg Thieme Verlag, Stuttgart 2012, abgerufen am 26. Dezember 2012.
- ↑ 3,0 3,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 124-40-3 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.