Tebbe-Methylenierung

Die Tebbe-Methylenierung, oder auch Tebbe-Reaktion, ist eine chemische Reaktion aus dem Bereich der Organischen Chemie. Sie dient der Methylenierung, also Einführung einer Methylengruppe. Als Edukte dienen Carbonylkomponenten wie Aldehyde, Ketone und Ester, aber auch Amide. Als Reagenzien werden titanhaltige Komplexe wie das Tebbe-, Petasis- oder Lombardo-Reagenz eingesetzt. Die Reaktion ist benannt nach ihrem Entwickler, dem dänischen Chemiker Frederick Nye Tebbe.[1][2][3]
Die Tebbe-Methylenierung stellt eine Alternative zur Wittig-Reaktion dar.

Mechanismus
Aus dem Tebbe-Reagenz wird zunächst durch Baseneinwirkung (beispielsweise Pyridin) das reaktive Schrock-Carben gebildet. Dieses addiert zunächst an die eingesetzte Carbonylverbindung unter Bildung eines Oxa-Derivats eines Titanacyclobutans. Dieses öffnet sich dann unter Freisetzung des Alkens und einer Titan-Sauerstoff-Spezies.

Es gibt jedoch Hinweise darauf, dass es sich bei dem Mechanismus nicht um einen reinen konzertierten Prozess wie bei der Olefinmetathese handelt sondern dass ionische Spezies als Reaktionszwischenprodukte auftreten.
Die Bildung des deformylierte Hauptprodukt ist über einen reinen konzertierten Mechanismus nicht zu erklären.[4]
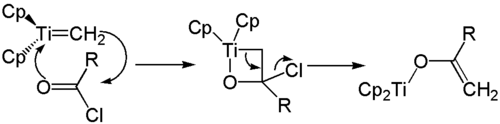
Werden Carbonsäurehalogenide als Carbonylkomponente eingesetzt, so öffnet sich der Vierring unter Abspaltung eines Halogenidions. Es bildet sich ein Enolat, das durch den gebundenen Titankomplex stabilisiert wird. Das gebildete Enaolat kann nun beispielsweise mit einem Alkylhalogenid zu einem Enolether umgesetzt werden.
Einsatzgebiet
Das Tebbe-Reagenz ermöglicht nur die Einführung von Methylengruppen, im Gegensatz zur Wittig-Reaktion, mit der ein breites Spektrum an Resten eingeführt werden kann. Ein Vorteil gegenüber der Wittig-Reaktion liegt in der Möglichkeit der Verwendung von Estern und Amiden, die in Wittig-Reaktionen nicht verwendet können.

Auch werden durch eine Tebbe-Methylenierung bei sterisch gehinderten Carbonylen deutlich höhere Ausbeuten erzielt. Chirale Kohlenstoffatome in α-Position zum Carbonyl racemisieren während einer Tebbe-Reaktion nicht.[5]
Eine Erweiterung des Einsatzbereiches ergibt sich durch die Verwendung des Petasis-Reagenz. Dieses erlaubt die Einführung eines breiteren Spektrums an Resten.
Für das Tebbe-Reagenz wurden Olefinmetathese-Eigenschaften beschrieben und dabei findet im Anschluss an die Olefinierungs-Reaktion eines Esters eine Olefinmetathese unter Bildung eines Enolethers statt.[6][7]
Einzelnachweise
- ↑ F. N. Tebbe, G. W. Parshall and G. S. Reddy: Olefin homologation with titanium methylene compounds, J. Am. Chem. Soc. 1978, 100, 3611–3613.
- ↑ S. H. Pine, Org. React. 1993, 43, 1.
- ↑ I. Beadham, J. Micklefield, J. Curr. Org. Syn. 2005, 2, 231–250.
- ↑ Kai Oesterreich, Dissertation Universität Hohenheim 2004, S. 61 ISBN 3-8325-0568-7.
- ↑ A. Marra, J. Esnault, A. Veyrieres, P. Sinay: Isopropenyl glycosides and congeners as novel classes of glycosyl donors: theme and variations, J. Am. Chem. Soc. 1992, 114, 6354–6360.
- ↑ K.C. Nicolaou, M.H.D. Postema: In J. Am. Chem. Soc. 1996, 118, 1565-1566.
- ↑ K.C. Nicolaou, M.H.D. Postema, E.W. Yue, A. Nadin: In J. Am. Chem. Soc 1996, 118, 10335-10336.