Tebbe-Reagenz
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|

| |||||||
| Allgemeines | |||||||
| Name | Tebbe-Reagenz | ||||||
| Andere Namen |
| ||||||
| Summenformel | C13H18AlClTi | ||||||
| CAS-Nummer | 67719-69-1 | ||||||
| Kurzbeschreibung |
roter Feststoff [1] | ||||||
| Eigenschaften | |||||||
| Molare Masse | 284,62 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
0,93 g·cm−3[1] | ||||||
| Löslichkeit |
| ||||||
| Sicherheitshinweise | |||||||
| |||||||
| LD50 |
636 mg/kg (Ratte, oral) [1] | ||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Das Tebbe-Reagenz (nach Frederick Nye Tebbe, kurz Fred Tebbe) ist eine metallorganische Verbindung, die der Methylenierung von Ketonen oder Estern, der Tebbe-Methylenierung, dient.[4] Es handelt sich hierbei um einen zweikernigen verbrückten Komplex mit einem Titan- und einem Aluminium-Kern. Am Titankern, der über eine Methylengruppe und über eine Chlorbrücke mit dem Aluminiumkern verbrückt ist, sind zwei Cyclopentadienyl-Reste gebunden. Am Aluminiumkern befinden sich noch zwei Methylreste. Das Tebbe-Reagenz ist ein pyrophorer roter Feststoff und wird deshalb nur unter Schutzgas gehandhabt. Kommerziell ist es meist als Lösung (zum Beispiel: in Toluol) erhältlich.
Herstellung
Tebbe-Reagenz wird aus Titanocendichlorid (Cp2Cl2Ti) und Trimethylaluminium durch dreitägiges Rühren bei Raumtemperatur hergestellt.[5] Das eigentlich zur Methylenierung benötigte Schrock-Carben kann hieraus in situ durch Behandlung mit milden Basen (zum Beispiel Pyridin) erhalten werden.
Reaktionsmechanismus
Das durch Basenzusatz erhaltene Schrock-Carben addiert zunächst an die Carbonylkomponente unter Bildung eines Oxatitanacyclobutans. Nach Ringöffnung erhält man das methylenierte Produkt.
Ähnlich wie im Falle Phosphors im Wittig-Reagenz ist die Affinität von Titan zu Sauerstoff Triebkraft der Reaktion.
Einsatzspektrum
Anders als bei anderen Olefinierungen (vgl. Wittig-Reaktion, Horner-Wadsworth-Emmons-Reaktion) ist der Einsatz des Tebbe-Reagenz auf die Einführung von Methylengruppen beschränkt. Allerdings können bei Verwendung des Tebbe-Reagenz auch Ester eingesetzt werden, die sich zum Beispiel mit der Wittig-Reaktion nicht umsetzen lassen.
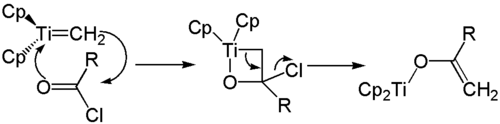
Ein weiteres Anwendungsgebiet des Tebbe-Reagenz liegt in der Synthese von Titanenolaten. Das aus einem Carbonsäurechlorid und dem Tebbe-Reagenz gewonnene Oxatitanacyclobutan-Derivat zerfällt unter Abspaltung des Chloridions zum Titanenolat.
Alternativen zum Tebbe-Reagenz sind das Petasis-Reagenz und das Lombardo-Reagenz.
Weblinks
Einzelnachweise
- ↑ 1,0 1,1 1,2 Datenblatt Tebbe-Reagenz bei Sigma-Aldrich, abgerufen am 6. Juni 2010.
- ↑ 2,0 2,1 mattmatter: µ-Chlorobis(cyclopentadienyl) (dimethylaluminum)-µ-methylenetitanium
- ↑ Diese Substanz wurde in Bezug auf ihre Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ F. N. Tebbe, G. W. Parshall, G. S. Reddy, J. Am. Chem. Soc., 1978, 100, S. 3611–3613.
- ↑ W.A. Herrmann, Advances in Organometallic Chemistry, 1982, 20, S. 195–197.