Aluminiumchlorid
| Kristallstruktur | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||
| __ Al3+ __ Cl− | |||||||||||||||
| Allgemeines | |||||||||||||||
| Name | Aluminiumchlorid | ||||||||||||||
| Andere Namen |
| ||||||||||||||
| Verhältnisformel | AlCl3 | ||||||||||||||
| CAS-Nummer | 7446-70-0 | ||||||||||||||
| PubChem | 24012 | ||||||||||||||
| Kurzbeschreibung |
weißer bis gelblicher Feststoff[1] mit stechendem Geruch | ||||||||||||||
| Arzneistoffangaben | |||||||||||||||
| Wirkstoffklasse | |||||||||||||||
| Verschreibungspflichtig: Nein | |||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse | 133,34 g·mol−1 | ||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||
| Dichte |
2,44 g·cm−3[2] | ||||||||||||||
| Sublimationspunkt | |||||||||||||||
| Dampfdruck | |||||||||||||||
| Löslichkeit |
450 g·l−1 in Wasser (Zersetzung[2]) | ||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| LD50 |
3450 mg·kg−1[2] | ||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||
| ΔHf0 |
−704 kJ·mol−1[5] | ||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||
Aluminiumchlorid ist eine anorganische chemische Verbindung; es ist das Chlorid des Aluminiums mit der Summenformel AlCl3.
Synthese
Wasserhaltiges Aluminiumchlorid (in rhombischen Kristallen auftretendes Hexahydrat AlCl3 · 6 H2O) entsteht durch Auflösen von Aluminium in Salzsäure:
Dieses Hexahydrat kann jedoch nicht entwässert werden, da es sich beim Erhitzen zu Aluminiumhydroxid bzw. Aluminiummetahydroxid und Chlorwasserstoffgas zersetzt:
So muss die Herstellung von wasserfreiem Aluminiumchlorid durch Überleiten von Chlor über Kohlenstoff und Aluminiumoxid bei etwa 800 °C oder direkt aus den Elementen erfolgen:
beziehungsweise:
Für die großtechnische Herstellung von Aluminiumchlorid werden aufgrund der hohen Aggressivität des Prozesses emaillierte Rührbehälter verwendet.
Eigenschaften


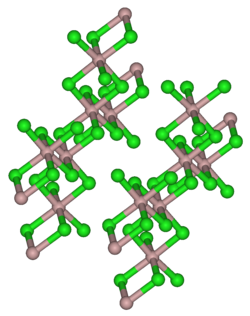
Aluminiumchlorid bildet farblose, hexagonale Kristalle. Es ist in vielen organischen Lösungsmitteln löslich. Das meist auf Grund von Verunreinigungen mit Eisenchloriden hellgelbe Pulver wirkt stark hygroskopisch. In feuchter Luft raucht es wegen teilweiser Hydrolyse zu Chlorwasserstoff und Aluminiumoxid-chlorid. In Wasser löst es sich unter starker Erwärmung unter Bildung des Hexahydrats. In unpolaren Lösungsmitteln, flüssiger Phase sowie im Dampfzustand tritt Aluminiumchlorid in einer dimeren Form als Cl2AlCl2AlCl2 auf, in dem das Aluminiumatom tetraedrisch koordiniert ist (analog zum Aluminiumbromid). Im festen Zustand liegt ein Ionengitter vor, in dem das Aluminiumion 6-fach durch Cl− koordiniert ist. Beim Schmelzen bricht das Ionengitter unter Bildung des Dimeren zusammen. Da dieses kovalent aufgebaut ist, leitet flüssiges Aluminiumchlorid den elektrischen Strom nur schlecht.[6]
Aluminiumchlorid wird als der Grenzfall zwischen Molekül und Ion angesehen, es hat eine delta-EN von 1,55 (nach Pauling). Damit sollte es sich eigentlich um eine polare Atombindung handeln.
Reaktionsverhalten
In stark exothermer Reaktion kommt Aluminiumchlorid in Wasser in Lösung, wobei eine Hydrolyse in Chloridionen und Hexaaquaaluminiumkomplexe erfolgt:
Diese Hexaaquaionen gehen schließlich in stark saurer Reaktion in eine Hydroxyverbindung über:
Verwendung

Trichlorid-Hexahydrat
Das Hexahydrat des Aluminiumchlorids findet auf Grund seiner stark adstringierenden Wirkung in der Textil- und Seifenindustrie Verwendung, wo es unter anderem der Herstellung von antiseptischen Mitteln oder Deodorants dient. Weiterhin wirkt es als starke Lewis-Säure sowie in der organischen Synthese (hier meist wasserfrei) als Katalysator bei Dehydrierungen, Polymerisationen und Friedel-Crafts-Reaktionen (Friedel-Crafts-Alkylierung, Friedel-Crafts-Acylierung). Außerdem wird es als Halogenüberträger und Kondensationsmittel verwendet.
Gegen leichte Entzündungen im Rachenraum werden aluminiumchloridhaltige Lösungen zum Gurgeln angeboten. Es ist in Apotheken erhältlich.
Wasserhaltiges Aluminiumchlorid bildet polymere Strukturen, die als Polyaluminiumchlorid (PAC) bekannt sind. Es gilt als effektives kombiniertes Flockungsmittel und Fällungsmittel, mit dem eine Reihe gelöster Stoffe in den ungelösten Zustand überführt und sehr unterschiedliche Arten von Schwebstoffen aus wässrigen Lösungen entfernt werden können.
Polymere Aluminiumchloride werden seit den 1970er Jahren u.a. im Rahmen der Aufbereitung von Betriebswasser, Trinkwasser, Abwasser und Schwimmbeckenwasser als Flockungsmittel und Fällungsmittel eingesetzt. In Europa haben PAC aufgrund technischer und wirtschaftlicher Merkmale das damals übliche Aluminiumsulfat im Bereich der Trinkwasseraufbereitung ersetzt. Außerhalb Europas hingegen ist die Verbreitung gering.
Verwendung als Antitranspirant (Schweißhemmer)
Aluminiumchlorid-Hexahydrat kann in bestimmten Konzentrationen durch lokales Auftragen gegen übermäßiges Schwitzen benutzt werden und dient daher auch als Wirkstoff in vielen Deos bzw. Antitranspirants. In diversen Foren finden sich Rezepte zum Herstellen eines Antitranspirants mit Aluminiumchlorid. Aluminiumchlorid ist ätzend, laut Erfahrungsberichten kann bei richtiger Dosierung jedoch lediglich eine leichte Reizung der Haut auftreten. Um diese zu lindern, sind den meisten Antitranspirants Glycerin (bzw. Glycerol) oder Pflanzenextrakte beigesetzt.
Gefahren
Aluminiumchlorid in Deodorants und Antitranspirants kann aufgrund der adstringierenden Wirkung der pH-sauren Lösung die Haut reizen. Es können lokale Rötungen, Jucken und Brennen auftreten. Die Bildung eines Ekzems ("Deo-Ekzem") und die Entwicklung einer dauerhaft allergischen Reaktion sind möglich.
Aluminiumchlorhydrate in Deodorants standen zeitweise im Verdacht, mit Brustkrebs in Verbindung zu stehen, da in Tumorgewebe akkumuliertes Aluminium gefunden worden war. Jedoch war der Zusammenhang mit der Entstehung von Brusttumoren unklar und die Aufnahme in die Zellen ungeklärt.[7] Eine Metastudie aus dem Jahr 2008, bei der die bisherigen Untersuchungen zu diesem Thema zusammengefasst wurden, kommt zu dem Schluss, dass es keine wissenschaftlichen Nachweise für diese Theorie gibt.[8] Das Deutsche Bundesinstitut für Risikobewertung BfR und der Krebsinformationsdienst KID (öffentliches Organ des Deutschen Krebsforschungszentrums DKFZ) sowie internationale Brustkrebsverbände geben offiziell Entwarnung. Eine Studie[9] aus dem Jahr 2012 mit menschlichen Brustzellkulturen wies unter Laborbedingungen auf eine zellbeeinträchtigende Wirkung von Aluminiumchlorid hin. Die Zellen zeigten abnormes Verhalten, das mit der ersten Phase einer tumorartigen Veränderung vergleichbar ist. Die in der Studie verwendeten Aluminiumchloride wurden direkt in die Zellkultur injiziert. Die natürliche Barriere der menschlichen Haut bleibt dabei unberücksichtigt. Insgesamt ist daher laut der Österreichischen Agentur für Gesundheit und Ernährungssicherheit (AGES)[10] zu sagen, dass wohl aufgrund der unterschiedlichen Ergebnisse weiterer Forschungsbedarf gegeben ist, um die Aufnahme von Aluminium nach dermaler Anwendung besser zu verstehen und eine etwaige Rolle von Aluminium bei Brustzellveränderungen abzuklären. Im Sinne eines vorbeugenden Gesundheitsschutzes sollten solche kosmetischen Mittel nicht in die frisch rasierte Achselhöhle eingebracht werden.
Handelspräparate
AHC20 (CH), AHC30 (CH), Everdry (D), Gargarisma zum Gurgeln (D), Mallebrin (D), Never-Sweat (D), Odaban (GB), Seven days (D), Sweat Protect (D), Yerka (D)
Einzelnachweise
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Datenblatt Aluminiumchlorid bei Merck, abgerufen am 24. April 2010.
- ↑ 3,0 3,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 7446-70-0 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ PAETEC Formelsammlung Ausgabe 2003, S. 116.
- ↑ Greenwood, Earnshaw, Die Chemie der Elemente, 1990, Wiley-VCH. ISBN 978-3-527-26169-7.
- ↑ P. D. Darbre: Aluminium, antiperspirants and breast cancer. J. Inorg. Biochem. (2005) 99(9): S. 1912-1919; PMID 16045991.
- ↑ Namer M, Luporsi E, Gligorov J, Lokiec F, Spielmann M.: The use of deodorants/antiperspirants does not constitute a risk factor for breast cancer. Centre Antoine-Lacassagne, Nice, France. (2008); PMID 18829420.
- ↑ Sappino AP, Buser R, Gimelli S, Béna F, Belin D and Mandriotab SJ. Aluminium chloride promotes anchorage independent growth in human mammary epithelial cells. J. Appl. Toxicol. 2012; 32:233–243
- ↑ Information zu Aluminiumchloridverwendung in Antitranspirantien der Österreichischen Agentur für Gesundheit und Ernährungssicherheit (AGES)
Aluminium(I)-Verbindungen: Aluminium(I)-fluorid | Aluminium(I)-chlorid | Aluminium(I)-bromid | Aluminium(I)-iodid
Aluminium(III)-Verbindungen: Aluminium(III)-fluorid | Aluminium(III)-chlorid | Aluminium(III)-bromid | Aluminium(III)-iodid
Andere: Aluminium(II)-chlorid | Aluminium(II)-iodid