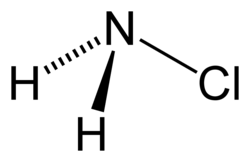
Monochloramin
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Allgemeines | |||||||
| Name | Monochloramin | ||||||
| Andere Namen |
Chloramin | ||||||
| Summenformel | NH2Cl | ||||||
| CAS-Nummer | 10599-90-3 | ||||||
| Eigenschaften | |||||||
| Molare Masse | 51,48 g·mol−1 | ||||||
| Schmelzpunkt | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Monochloramin ist eine chemische Verbindung, die als Desinfektionsmittel eingesetzt wird und zur Gruppe der Chloramine gehört. In reiner Form ist Monochloramin instabil und zersetzt sich bei Temperaturen von über −110 °C; ab −40 °C verläuft die Zersetzung heftig bis explosionsartig. Bei niedrigen Drücken sowie in verdünnten Lösungen ist es stabil.[1]
Vorkommen
Monochloramin kann durch Reaktion von Chlor mit stickstoffhaltigen Verbindungen z. B. in Schwimmbädern[3] entstehen.
Gewinnung und Darstellung
Monochloramin kann gewonnen werden durch Reaktion von Ammoniak (oder Ammoniakverbindungen) mit Hypochloriger Säure[4] unter leicht alkalischen Bedingungen:
Die Verwendung von Chlor ist weniger ratsam aufgrund der Bildung explosiven Stickstofftrichlorids als Nebenprodukt.[5]
Verwendung
Monochloramin wird in geringer Konzentration in den USA als Desinfektionsmittel in Wasserversorgungssystemen als Alternative zur Chlorung eingesetzt. Des Weiteren bildet Monochloramin ein wichtiges Zwischenprodukt bei der Hydrazin-Synthese nach dem Raschig-Verfahren. Monochloramin bildet mit Phenolen in Anwesenheit eines Katalysators blaue Indophenolfarbstoffe, was als Nachweis genutzt werden kann.
Sicherheitshinweise
Monochloramin ist giftig für bestimmte Fischarten.
Einzelnachweise
- ↑ 1,0 1,1 Holleman-Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, Berlin 2007. ISBN 978-3-11-017770-1.
- ↑ Diese Substanz wurde in Bezug auf ihre Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Chlorierung von Trinkwasser (TU Freiberg).
- ↑ Fair, G. M., J. C. Morris, S. L. Chang, I. Weil, and R. P. Burden. 1948. The behavior of chlorine as a water disinfectant. J. Am. Water Works Assoc. 40: 1051–1061.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 477–479.
Oxidationsstufe (III): Stickstofftrifluorid | Stickstofftrichlorid | Stickstofftribromid | Iodstickstoff
Andere Oxidationsstufen: Stickstoff(II)-fluorid | Distickstofftetrachlorid | Stickstoff(I)-fluorid | Distickstoffdichlorid
Halogenamine: Monofluoramin | Difluoramin | Monochloramin | Dichloramin | Monobromamin | Dibromamin | Monoiodamin | Diiodamin