Calciumformiat
| Strukturformel | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||
| Allgemeines | |||||||||||||||
| Name | Calciumformiat | ||||||||||||||
| Andere Namen |
| ||||||||||||||
| Summenformel | C2H2CaO4 | ||||||||||||||
| CAS-Nummer | 544-17-2 | ||||||||||||||
| PubChem | 10997 | ||||||||||||||
| Kurzbeschreibung |
farbloser, fast geruchloser Feststoff[1] | ||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse | 130,11 g·mol−1 | ||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||
| Dichte |
2,02 g·cm−3[2] | ||||||||||||||
| Schmelzpunkt |
>380 °C (Zersetzung)[2] | ||||||||||||||
| Löslichkeit | |||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| LD50 |
2650 mg·kg−1 (Ratte, oral)[2] | ||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||
Calciumformiat ist eine chemische Verbindung aus der Gruppe der Formiate, also das Calciumsalz der Ameisensäure.
Vorkommen
Calciumformiat kommt sehr selten in Form des Minerals Formicait vor.[5]
Gewinnung und Darstellung
Calciumformiat kann durch Reaktion von Kohlenmonoxid mit Calciumhydroxid[6]
oder Reaktion von Formaldehyd mit einer Calciumverbindung in wässriger Lösung (zum Beispiel Calciumhydroxid oder Calciumperoxid) gewonnen werden.[7] Es entsteht auch als Beiprodukt bei der Herstellung von Polyolen (zum Beispiel Trimethylolpropan).[8]
Eigenschaften
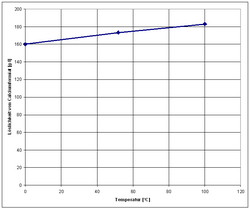
Calciumformiat ist farbloser, fast geruchloser Feststoff. Es ist das Calciumsalz der Ameisensäure. Es kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pcab mit den Gitterparametern a = 1016,8 pm, b = 1340,7 pm und c = 627,8 pm. In der Elementarzelle befinden sich acht Formeleinheiten.[10]
Verwendung
Calciumformiat wird zur Erzeugung von Ameisensäure, als Hilfsmittel in der Gerberei, als Abbindebeschleuniger für zementgebundene Baustoffe, als Hilfsmittel zur Aufarbeitung von Ölemulsionen, zur Herstellung von Silierhilfsmitteln und Additive für die Tierernährung verwendet.[11] Die Verbindung wurde früher auch als Lebensmittelzusatzstoff (Konservierungsstoff E238) eingesetzt, ist aber seit 1998 nicht mehr zugelassen.[12][13]
Weblinks
Einzelnachweise
- ↑ Hermann Römpp: Chemie Lexikon. 5. Auflage. Franckh'sche Verlagsbuchhandlung, W. Keller & Co., Stuttgart 1962.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Eintrag zu CAS-Nr. 544-17-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Oktober 2009 (JavaScript erforderlich)
- ↑ Richard J. Lewis, Sr.: Hawley's Condensed Chemical Dictionary. 15 Auflage. Wiley-Interscience, 2007, ISBN 978-0471768654.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Formicait (mineralienatlas.de)
- ↑ Ullmann's Enzyklopädie der Organischen Chemie
- ↑ Process for preparing calcium formate (freepatentsonline)
- ↑ Calciumformate (runyoutech.com)
- ↑ H. Stanley: "The Solubility of Some Salts of the Lower Fatty Acids" in The Chemical News 1904, 89, S. 193. Volltext
- ↑ N. Burger, H. Fuess, S. A. Mason: "Neutron diffraction of [alpha]-calcium formate at 100 and 296 K" in Acta Cryst. 1977, B33, S. 1968–1970, doi:10.1107/S0567740877007444
- ↑ Anwendungen Calciumformiat, Chemische Fabrik Kalk.
- ↑ Calciumformiat als Lebensmittelzusatzstoff (bdsoft)
- ↑ Zusatzstoffe in der EU (Stand Dezember 2011)