Barbitursäure
- Seiten mit defekten Dateilinks
- Barbiturat
- Pyrimidin
- Imid
- Harnstoff
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||
| Name | Barbitursäure | ||||||
| Andere Namen |
| ||||||
| Summenformel | C4H4N2O3 | ||||||
| CAS-Nummer | 67-52-7 | ||||||
| PubChem | 6211 | ||||||
| Kurzbeschreibung |
farbloses, kristallines Pulver mit schwachem Geruch[1] | ||||||
| Eigenschaften | |||||||
| Molare Masse | 128,09 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit |
mäßig in Wasser (142 g·l−1 bei 20 °C)[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| LD50 | |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Barbitursäure ist eine heterocyclische chemische Verbindung, die als Ausgangssubstanz zur Herstellung der Barbiturate und in der Analytik Verwendung findet. Die Substanz zählt zu den Derivaten des Harnstoffs, zu den Lactamen und ist gleichzeitig ein hydrierter Abkömmling des Pyrimidins.
Geschichte
Die Konstitution der Barbitursäure wurde erstmals 1864 von Adolf von Baeyer bei seinen Studien über Harnsäure erkannt.[3] Er soll seine Entdeckung nach seiner Geliebten Barbara benannt haben.[4] Nach anderen Quellen bekam die Barbitursäure zu Ehren der Alchemistin Barbara von Cilli (1390–1451) ihren Namen.[5]
Baeyer fand heraus, dass die Verbindung zu Harnstoff und Malonsäure hydrolysiert werden kann. Die Synthese aus diesen Abbauprodukten wurde 1879 von dem französischen Chemiker Grimaux realisiert, der diese mit Phosphoroxychlorid als wasserentziehendem Mittel reagieren ließ.[6]
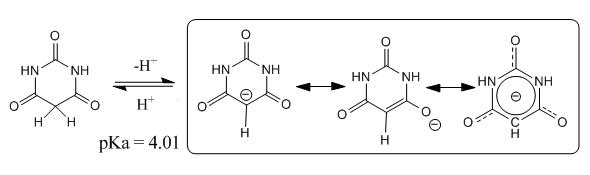
Acidität und Tautomerie
Wie der Name sagt, reagiert die Verbindung sauer. Ihr pKa-Wert beträgt 4,01. Daher wurde früher diskutiert, ob die Formel der Barbitursäure nicht als 2,4,6-Trihydroxypyrimidin geschrieben werden sollte. Dies ist eine tautomere Form des cyclischen Harnstoff-Derivates.
Später wurde erkannt, dass die Imid-Form selbst als Säure fungieren kann: Ihr Anion (Barbiturat) ist stabilisiert durch Delokalisation der negativen Ladung.
Synthese
Barbitursäure kann aus Harnstoff und einem Malonsäureester, z.B. Malonsäurediethylester, in wasserfreiem Ethanol mit darin gelöstem Natriumethanolat hergestellt werden:
Verwendung
Barbitursäure ist selbst nicht sedativ-hypnotisch wirksam. Erst Derivate mit geeigneten Substituenten besitzen eine hypnotische Wirkung (siehe Barbiturate). Als erstes derartiges Barbiturat wurde 1903 Diethylbarbiturat (Barbital) von Emil Fischer und Joseph von Mering beschrieben.[7]
In der Trink- und Abwasseranalytik wird Barbitursäure als Reagenz zur kolorimetrischen Cyanidanalyse (CN−-Ion) verwendet.
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 Eintrag zu Barbitursäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Juni 2007 (JavaScript erforderlich).
- ↑ Barbitursäure bei ChemIDplus.
- ↑ Adolf Baeyer (1864): Untersuchungen über die Harnsäuregruppe. In: Justus Liebigs Annalen der Chemie. Bd. 131, Nr. 3, S. 291–302. doi:10.1002/jlac.18641310306.
- ↑ Werner Gerabek: Enzyklopädie Medizingeschichte. Walter de Gruyter, Berlin; New York 2005, ISBN 3-11-015714-4, S. 138.
- ↑ Geschichte eines Schlafmittels, Pharmazeutische Zeitung
- ↑ Grimaux, Bulletin de la Societe Chimique de France, Serie 2, 31, 146 (1879). Annales de Chimie, Serie 5, 17, 277. Zitiert nach Beilsteins Handbuch der Organischen Chemie, Band 24, S. 467
- ↑ E. Fischer & J. von Mering (1903): Über eine neue Klasse von Schlafmitteln. In: Therapie der Gegenwart. Bd. 44, S. 97–101.
Literatur
- J. R. Partington, A History of Chemistry, Band 4, 777 (1964).
- Beyer-Walter, Lehrbuch der Organischen Chemie, 21. Auflage, S. 784 , Hirzel, Stuttgart, 1988.
Weblinks