Eisen(II)-oxalat
| Strukturformel | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
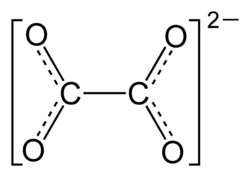
| |||||||||||||||
| Allgemeines | |||||||||||||||
| Name | Eisen(II)-oxalat | ||||||||||||||
| Andere Namen |
Ferrooxalat | ||||||||||||||
| Summenformel | FeC2O4 | ||||||||||||||
| CAS-Nummer |
| ||||||||||||||
| Kurzbeschreibung |
gelbes Pulver[1] | ||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse | 143,85 g·mol−1 | ||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||
| Dichte |
2,28 g·cm−3 (Dihydrat)[1] | ||||||||||||||
| Schmelzpunkt | |||||||||||||||
| Löslichkeit | |||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||
Eisen(II)-oxalat ist ein Eisensalz der Oxalsäure.
Vorkommen
Natürlich kommt Eisen(II)-oxalat-dihydrat als Mineral Humboldtin (nach Friedrich Heinrich Alexander von Humboldt) vor.[5]
Gewinnung und Darstellung
Man kann Eisen(II)-oxalat durch die Reaktion von wässrigen Eisen(II)-salzlösungen mit Oxalsäure oder Alkalioxalaten herstellen.
Eigenschaften

Eisen(II)-oxalat bildet blassgelbe, rhombische Kristalle. Das Dihydrat kommt in zwei verschiedenen (monoklin und orthorhombisch) Kristallformen vor.[7][8]
Wird Eisen(II)-oxalat auf über 190 °C erhitzt, so erhält man die sogenannte Wüstit-Phase[9] , ein schwarzes Eisenoxid-Produkt, das einen mehr oder minder großen Eisenunterschuß gegenüber der Formel FeO aufweist. Nachfolgend die Gleichung dieser Reaktion:
- .
- Eisenoxalat zerfällt bei Erhitzung zu → Eisen(II)-oxid + Kohlenstoffmonoxid + Kohlenstoffdioxid
Unter bestimmten Bedingungen kann über diese Reaktion auch stöchiometrisches Eisen(II)-oxid dargestellt werden (siehe hier).
Verwendung
Verwendung findet Eisen(II)-oxalat seit 1879 in der Fotografie als Entwickler.[10] Es wird weiterhin für optische Gläser verwendet.[11]
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 Datenblatt Eisen(II)-oxalat (Dihydrat) bei AlfaAesar, abgerufen am 7. Januar 2010 (JavaScript erforderlich)..
- ↑ Ferrous oxalate, battery grade (Mutual Chemical)
- ↑ 3,0 3,1 Datenblatt Iron(II) oxalate dihydrate bei Sigma-Aldrich, abgerufen am 29. März 2011.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Humboldtin (mindat)
- ↑ http://www.freepatentsonline.com/3846460.html
- ↑ I. Sledzinska and A. Murasik: "Nuclear and magnetic diffuse scattering of neutrons from β-ferrous oxalate dihydrate", in: Journal of Applied Crystallography, 1988, 21 (5), 504–511; doi:10.1107/S0021889888005758.
- ↑ Mössbauer spectroscopy of polymorphous iron oxalate (Hyperfine Interactions)
- ↑ Holleman-Wiberg: Lehrbuch der anorganischen Chemie, 37.-39. Auflage, Walter de Gruyter Verlag, Berlin 1956, S. 534.
- ↑ Sir William De W. Abney: "Instruction in Photography" (eingeschränkte Vorschau in der Google Buchsuche)
- ↑ Spektroskopische Untersuchungen (Schott)
Weblinks
- Structural, magnetic and size transformations induced by isothermal treatment of ferrous oxalate dihydrate in static air conditions
- William Allen Miller: Elements of chemistry: theoretical and practical, Band 2 (eingeschränkte Vorschau in der Google Buchsuche)