Carbenkomplexe
Carbenkomplexe sind Übergangsmetallkomplexe, die formal mindestens eine Metall-Kohlenstoff-Doppelbindung enthalten. Sie sind somit metallorganische Verbindungen und werden in zwei Untergruppen – Fischer-Carbene und Schrock-Carbene – eingeteilt, wobei die elektronische Umgebung des gebundenen Kohlenstoffatoms entscheidend ist. Der bindende Kohlenstoff in Fischer-Carbenen ist durch elektronenziehende Gruppen substituiert und damit elektrophil. Bei Schrock-Carbenen handelt es sich durch seine elektronenschiebenden Substituenten um einen nucleophilen Kohlenstoff. Eine luftstabile Weiterentwicklung von Schrock-Carbenen stellt der Grubbs-Katalysator dar, der mittlerweile in Olefinmetathese-Reaktionen eine Anwendung findet.
Geschichte
Bereits im Jahr 1915 stellte Lew Alexandrowitsch Tschugajew den ersten Carbenkomplex durch Umsetzung von Tetrakis(methylisocyanid)-platin(II) mit Hydrazin her.[1] Er erkannte jedoch nicht die Natur dieser Verbindung. Die Aufklärung der Struktur des entstehenden Carbenkomplexes gelang erst in den 1970er Jahren.[2] Im Jahre 1963 setzte M. Ryang Eisenpentacarbonyl mit lithiumorganischen Verbindungen zu Aldehyden und Ketonen um. Die Bildung der intermediären Carbenkomplexe wurde von ihm nicht erkannt.
Im Jahr 1964 setzte Ernst Otto Fischer an der Technischen Universität München Chromhexacarbonyl mit Phenyllithium um. Nach Alkylierung mit dem Meerwein-Salz Trimethyloxoniumtetrafluoroborat gelangte er zum ersten nachgewiesenen Carbenkomplex. Die Komplexklasse wurde nach ihrem Entdecker Fischer-Carbene benannt.
Bindungsverhältnis
Formal handelt es sich bei dem freien Carben um ein Singulett-Carben (beide Elektronen sind in einem Orbital, Multiplizität 1). Die σ-Hinbindung erfolgt durch ein doppelt besetztes Carbenorbital, die π-Rückbindung durch das doppelt besetzte Metallorbital.
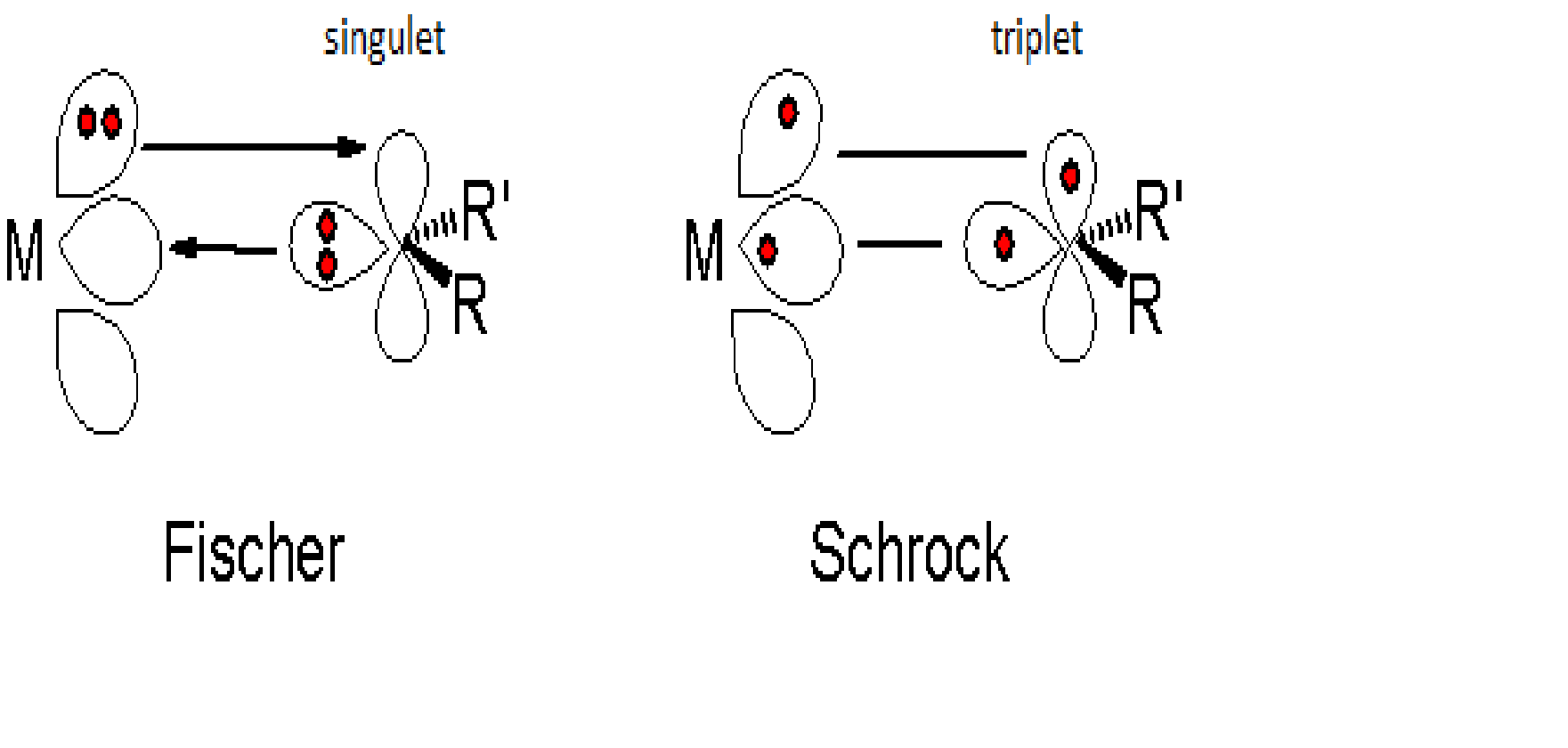
Näherungsweise können die Bindungsverhältnisse durch folgende mesomere Grenzstrukturen ausgedrückt werden:

Die Bindung ist polarisiert, wobei δ- dem Metall und δ+ dem Kohlenstoff zukommt. Da der Carbenkohlenstoff positiv polarisiert ist, spricht man von einem elektrophilen Carben.
Bei Schrock-Carbenen handelt es sich formal beim freien Carben um ein Triplettcarben. Das heißt, dass sich die beiden Elektronen des Carbens in zwei verschiedenen Orbitalen befinden, woraus sich eine Multiplizität von drei ergibt. Die σ-Hinbindung sowie die π-Rückbindung werden also jeweils durch ein Elektron des Metalls und des Liganden gebildet.
Fischer-Carbene

Unter Fischer-Carbenen versteht man Carbenkomplexe, die am carbenoiden Kohlenstoff ein Heteroatom tragen. Fischer-Carbene werden mit späten Übergangsmetallen in niedrigen Oxidationsstufen gebildet und haben elektrophilen Charakter.
Darstellung
Fischer-Carbene können leicht durch Addition von Metallorganylen an Carbonylkomplexe und anschließende Alkylierung erhalten werden. Hierzu kann zum Beispiel ein Lithiumalkyl eingesetzt werden, das zunächst an den Carbonylliganden addiert. Die Alkylierung wird meist mit dem Meerwein-Salz Trimethyloxoniumtetrafluoroborat durchgeführt.[3]

E. O. Fischer untersuchte die Chemie der Carbenkomplexe eingehend. Neben der ursprünglichen Methode des nucleophilen Angriffs an Metallcarbonylen entwickelte er weitere Methoden. So gelang ihm die Übertragung von Carbenliganden durch photochemische Anregung auf andere Komplexe.[4] Durch nucleophilen Angriff an Carbinkohlenstoff eines kationischen Carbinkomplexen mit Cyanid- und Rhodanid-Ionen gelang Fischer die Darstellung neuartiger Carbenkomplexe. [5]
Analog zur Fischer-Methode können Carbenkomplexe durch nucleophilen Angriff an Isocyanidkomplexen dargestellt werden. Joseph Chatt gelangte durch die Umsetzung einer Reihe von Isocyanidkomplexen des Typs [PtCl2 (PhNC) (PEt3)] mit Ethanol zu kristallinen Carbenkomplexen.[6]
Die Synthesechemie der Carbenkomplexe ist vielfältig. Wolfgang A. Herrmann gelang die Darstellung von Carbenkomplexen durch die Umsetzung von Halbsandwichkomplexen des Mangans mit Diazoverbindungen.[7] Ulrich Schöllkopf alkylierte Quecksilber-Acylkomplexe und gelangte auf diesem Weg zu Carbenkomplexen.[8] Öfele setzte Metallcarbonylate wie Dinatriumchrompentacarbonylat mit 1,1-Dichlorcyclopropenderivaten zum Carbenkomplex Pentacarbonyl(2,3-diphenylcyclopropenyliden)-chrom(0) um.[9]
Cardin gelang die Darstellung von Carbenkomplexen durch die Spaltung einer C=C-Doppelbindung mit Platinkomplexen des Typs ((PR3)PtCl2)2.[10] Daneben gelingt die Modifizierung von Carbenkomplexen wie der Ersatz von nicht-Carbenliganden, etwa von Kohlenstoffmonoxid durch einen Phosphanliganden, oder durch Reaktionen am Liganden, wie etwa Substitutionen.
Reaktionen
Die Reaktionen der Fischer-Carbene sind vielfältig und können unterteilt werden in Reaktionen am nicht-Carbenliganden, etwa dessen Substitution durch einen anderen Liganden, die Substitution des Carbenliganden und Additionsreaktionen am Carbenkohlenstoff. Des Weiteren sind Reaktionen am Carbenliganden möglich sowie Umlagerungen. Fischer-Carbene werden in der Dötz-Reaktion eingesetzt.
Schrock-Carbene

Unter Schrock-Carbenen versteht man nukleophile Carbenkomplexe, die im Gegensatz zu Fischer-Carbenen nicht heteroatomsubstituiert sind. Sie werden mit frühen Übergangsmetallen in hohen Oxidationsstufen gebildet und sind benannt nach Richard R. Schrock.
Darstellung
Eine Möglichkeit der Synthese von Schrock-Carbenen ist in folgendem Schema gegeben. Tantal(V)-pentachlorid wird mit Neopentyllithium zur Reaktion gebracht. Hierbei bildet sich das kurzlebige Intermediat Tantal(V)-pentaneopentylat. Dieses zerfällt unter Eliminierung von Neopentan zum Schrock-Carben.

Da Schrock-Carbene oft wenig stabil sind, werden sie häufig erst kurz vor ihrer Verwendung hergestellt.
Reaktionen
Schrock-Carbene werden zu Alkylenierungen eingesetzt. So zum Beispiel das Tebbe-Reagenz zur Methylenierung, also dem Einführen einer Methylengruppe, von Ketonen. Auch die zur Olefinmetathese benutzten Katalysatoren, z.B. der Grubbs-Katalysator, sind Schrock-Carbene.
Siehe auch
Literatur
- E. Riedel (Hrsg.): Moderne Anorganische Chemie, de Gruyter, 3. Aufl., Berlin 2007, ISBN 978-3-11-019060-1.
- C. Elschenbroich: Organometallchemie, Teubner, 5. Aufl., Wiesbaden 2005, ISBN 3-519-53501-7.
- Karl Dotz: Transition Metal Carbene Complexes, 264 Seiten, Verlag Chemie, Weinheim, (Juni 1983) ISBN 0-89573-073-1
- Ernst Otto Fischer: Auf dem Weg zu Carben- und Carbinkomplexen (Nobel-Vortrag). In: Angewandte Chemie. 86, Nr. 18, 1974, S. 651-663, doi:10.1002/ange.19740861802.
Einzelnachweise
- ↑ L. Chugaev and M. Skanavy-Grigorieva, J. Russ. Chem. Soc., 47 (1915), S. 776
- ↑ A. Burke, Alan L. Balch, John H. Enemark: Palladium and platinum complex resulting from the addition of hydrazine to coordinated isocyanide. In: Journal of the American Chemical Society. 92, 1970, S. 2555–2557, doi:10.1021/ja00711a063.
- ↑ E. O. Fischer, A. Maasboel: Zur Frage eines Wolfram-Carbonyl-Carben-Komplexes. In: Angewandte Chemie. 76, 1964, S. 645–645, doi:10.1002/ange.19640761405.
- ↑ E. O. Fischer, H.-J. Beck: Übertragung des Methoxyphenylcarben-Liganden von Molybdän auf Eisen und Nickel. In: Angewandte Chemie. 82, 1970, S. 44–45, doi:10.1002/ange.19700820109.
- ↑ Ernst Otto Fischer, Peter Stückler, Fritz Roland Kreißl: Übergangsmetall-carben-komplexe. In: Journal of Organometallic Chemistry. 129, 1977, S. 197–202, doi:10.1016/S0022-328X(00)92491-4.
- ↑ E. M. Badley, J. Chatt, R. L. Richards, G. A. Sim: The reactions of isocyanide complexes of platinum(II): a convenient route to carbene complexes. In: Journal of the Chemical Society D: Chemical Communications. 1969, S. 1322, doi:10.1039/C29690001322.
- ↑ Wolfgang Anton Herrmann: Ein neues Verfahren zur Darstellung von Übergangsmetall-Carben-Komplexen. In: Angewandte Chemie. 86, 1974, S. 556–557, doi:10.1002/ange.19740861508.
- ↑ U. Schöllkopf, F. Gerhart: Synthese und Reaktionen stabiler Quecksilber-Carben-Komplexe. In: Angewandte Chemie. 79, 1967, S. 990–990, doi:10.1002/ange.19670792232.
- ↑ K. Öfele: Pentacarbonyl(2,3-diphenylcyclopropenyliden)-chrom(0). In: Angewandte Chemie. 80, 1968, S. 1032–1033, doi:10.1002/ange.19680802410.
- ↑ D. J. Cardin, B. Cetinkaya, M. F. Lappert: Transition metal-carbene complexes. In: Chemical Reviews. 72, 1972, S. 545–574, doi:10.1021/cr60279a006.
Weblinks
- José Barluenga: [pac.iupac.org/publications/pac/pdf/2002/pdf/7408x1317.pdf Fischer carbene complexes. A new tool for heterocyclic synthesis.] IUPAC, 6. März 2002, abgerufen am 25. August 2012.