Adenosintriphosphat
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||
| Name | Adenosintriphosphat | ||||||
| Summenformel | C10H16N5O13P3 | ||||||
| CAS-Nummer | 56-65-5 | ||||||
| PubChem | 238 | ||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||
| Eigenschaften | |||||||
| Molare Masse | 507,18 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
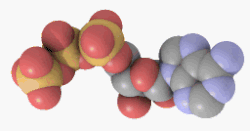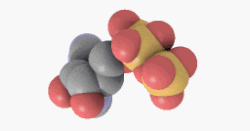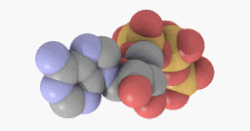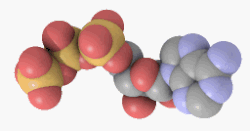
Adenosintriphosphat (ATP) ist ein Nukleotid, bestehend aus dem Triphosphat des Nucleosids Adenosin (und als solches ein energiereicher Baustein der Nukleinsäure RNA).
ATP ist jedoch hauptsächlich der universelle und unmittelbar verfügbarere Energieträger in jeder Zelle und gleichzeitig ein wichtiger Regulator energieliefernder Prozesse. ATP wird bei Bedarf aus anderen Energiespeichern (Kreatinphosphat, Glykogen, Fettsäuren) resynthetisiert. Das ATP-Molekül besteht aus einem Adeninrest, dem Zucker Ribose und drei Phosphaten (α bis γ) in Ester- (α) bzw. Anhydridbindung (β und γ).
Geschichte
ATP wurde 1929 von dem deutschen Biochemiker Karl Lohmann entdeckt. Eine chemische Synthese von ATP wurde erstmals 1949 von James Baddiley und Alexander Robertus Todd veröffentlicht. Die Rolle als Haupt-Energiequelle in Zellen wurde 1939 bis 1941 von Fritz Lipmann aufgeklärt[3], nachdem schon Wladimir Alexandrowitsch Engelhardt 1935 gezeigt hatte, dass ATP für Muskelkontraktionen notwendig ist, und Herman Kalckar 1937 die Verbindung von ATP-Synthase mit der Atmungskette festgestellt hatte. Die ersten an der Synthese von ATP beteiligten Enzyme wurden von Efraim Racker ab 1961 bestimmt.
ATP als Energieträger
Bedeutung als Energieträger für den Organismus
Für in Zellen ablaufende Prozesse wird Energie benötigt, um damit chemische, osmotische oder mechanische Arbeit leisten zu können. Diese Energie muss bereitgestellt werden. Dies geschieht über das Molekül ATP. Die Bindungen der drei Phosphate sind sehr energiereiche chemische Bindungen. Die Phosphate sind über Phosphoanhydrid-Bindungen (Säureanhydrid-Bindungen) miteinander verbunden. Werden diese Bindungen durch Enzyme hydrolytisch gespalten, entsteht das Adenosindiphosphat (ADP) bzw. das Adenosinmonophosphat (AMP) und Phosphat. Dabei werden jeweils etwa 32,3 kJ/mol (Spaltung einer Bindung) oder 64,6 kJ/mol (Spaltung beider Bindungen) Energie für Arbeitsleistungen in den Zellen frei.
Als Energiequelle wird ATP für die grundlegenden energieverbrauchenden Prozesse aller Lebewesen genutzt: Synthese von organischen Molekülen, aktiver Stofftransport durch Biomembranen hindurch in die Zellen oder hinaus sowie Bewegungen wie zum Beispiel bei der Muskelkontraktion.
ATP als Signalmolekül
Intrazelluläre Signalgebung
ATP ist ein Cosubstrat der Kinasen, einer Gruppe von Phosphat-übertragenden Enzymen, die im Metabolismus und bei der Stoffwechselregulation eine Schlüsselrolle spielen. Bedeutende Mitglieder der letzteren Gruppe sind die Proteinkinasen, die je nach ihrem Aktivierungsmechanismus als Proteinkinase A (PKA, cAMP-abhängig), Proteinkinase C (PKC, Calcium-abhängig), Calmodulin-abhängige Kinase, oder Insulin-stimulierte Proteinkinase (ISPK) bezeichnet werden, um nur einige Beispiele zu nennen. Unter Blutzucker werden einige Grundprinzipien angesprochen, nach denen eine Serie von Kinasen zu einer Enzymkaskade zusammengeschaltet sein kann.
Extrazelluläre Signalgebung
ATP (wie auch ADP und Adenosin) sind Agonisten purinerger Rezeptoren, die sowohl im zentralen als auch im peripheren Nervensystem eine Rolle spielen. Somit ist es beteiligt an Prozessen wie der Durchblutungsregulation oder der Vermittlung von Entzündungsreaktionen. Es wird nach neuronalen Verletzungen ausgeschüttet und kann die Proliferation von Astrozyten und Neuronen stimulieren.
Regeneration des ATP
Aus dem bei der Energieabgabe aus ATP entstandenen AMP bzw. ADP regeneriert die Zelle das ATP. Dafür gibt es zwei verschiedene Prinzipien, die als Substratkettenphosphorylierung und Elektronentransportphosphorylierung (Atmungskette) bezeichnet werden.
Bei der Substratkettenphosphorylierung wird ein Phosphatrest an ein Zwischenprodukt des Abbaus von Energiequellen gebunden und nach weiterem Umbau des Zwischenprodukts auf ADP übertragen.
Bei der Elektronentransportphosphorylierung werden durch einen Transport von Elektronen entlang eines Redoxgradienten über verschiedene Elektronen- und Wasserstoff-Überträger in einer Membran Protonen von einem durch die Membran umschlossenen Raum der Zelle in einen anderen transloziert. In Bakterien werden so Protonen nach außen gepumpt. In Eukaryoten finden diese Prozesse in den Mitochondrien statt. Dort werden aus der Matrix des Mitochondriums Protonen in den Intermembranraum exportiert. In beiden Fällen wird ein elektrochemischer Gradient erzeugt, der sich aus einem Protonenkonzentrationsunterschied und über ein elektrisches Potential zusammensetzt. Der Rückfluss der Protonen durch das ebenfalls in der Membran lokalisierte Enzym ATP-Synthase treibt die von diesem Enzym katalysierte energieverbrauchende Bindung anorganischer Phosphatreste an das ADP an. In manchen Organismen werden anstatt Protonen Natriumionen verwendet, sie verfügen analog über eine Na+-abhängige ATP-Synthase.
Bei chemotrophen Organismen werden die Elektronen in Form von Reduktionsäquivalenten (NADH, NADPH, FADH2 oder reduziertes Ferredoxin) in die Atmungskette eingespeist. Diese stammen aus dem oxidativen Abbau energiereicher Verbindungen, wie beispielsweise Kohlenhydrate oder Fettsäuren. Die Elektronen werden bei aeroben Organismen auf Sauerstoff übertragen, dabei entsteht Wasser. In der anaerober Atmung stehen andere Elektronenakzeptoren zur Verfügung, beispielsweise Schwefel oder Eisen(II). In beiden Fällen entsteht ein elektrochemischer Gradient, der zur ATP-Generierung genutzt wird. Bei Eukaryoten findet der Vorgang in den Mitochondrien, bei Prokaryoten im Cytoplasma statt.
Bei phototrophen Organismen werden Elektronen nach Absorption von Licht durch Chlorophylle auf einem hohen Energieniveau abgegeben. Die Lichtenergie wird damit genutzt, um einen elektrochemischen Gradienten zu erzeugen. Bei grünen Pflanzen findet dies in den Chloroplasten, bei Bakterien im Cytoplasma statt. Wegen der Nutzung des Lichtes spricht man deshalb in diesem Fall von Photophosphorylierung.
Kurzzeitregeneration in Muskelzellen
Da die oxidative Phosphorylierung in der Atmungskette ein relativ langsamer Prozess ist, muss der ATP-Vorrat in stark beanspruchten Zellen (Muskelzellen) auch kurzfristig wieder aufgefüllt werden. Der ATP-Vorrat (in der Muskelzelle ca. 6 mmol/kg Muskel) reicht bei maximaler Kontraktion nur ca. 2−3 Sekunden. Eine Reserve stellen hier Moleküle mit höherem Gruppenübertragungspotenzial als ATP dar. Säugetiermuskelzellen halten einen Vorrat an Kreatinphosphat (21 mmol/kg Muskel; 0,08 % pro Körpergewicht[4]) bereit. Die Creatin-Kinase katalysiert die Übertragung der Phosphorylgruppe vom Kreatinphosphat an das ADP. Ist dieser Vorrat nach 6−10 Sekunden verbraucht, müssen die oben genannten Mechanismen die ATP-Regeneration alleine tragen.
Weitere Formen der Energiebereitstellung in Muskelzellen
Während starker Muskelbeanspruchung bauen Muskelzellen Glucose zu Lactat in Milchsäuregärung ab, um schnell ATP zu erzeugen. Lactat selbst wird in der Leber wieder zu Pyruvat und dann zu Glucose unter ATP-Verbrauch aufgebaut (Gluconeogenese). Diese Glucose wird dann wieder dem Muskel als Energiequelle zur Verfügung gestellt. Dieser Kreislauf wird auch als Cori-Zyklus bezeichnet.
Im Notfall werden zur Energieerzeugung auch körpereigene Proteine abgebaut. Proteine werden in Aminosäuren zerlegt, und diese meistens zu Pyruvat abgebaut. In einem dem Cori-Zyklus ähnlichen Weg wird Pyruvat zunächst zu Alanin transaminiert und zur Leber transportiert. Dort kehren sich diese Schritte um und die Leber erzeugt aus Pyruvat wieder Glucose, die dem Muskel bereitgestellt wird. Dieser Zyklus wird auch als Glucose-Alanin-Zyklus bezeichnet.
Energiebereitstellung im Herzmuskel
Der Herzmuskel nutzt Fettsäuren als Brennstoff, diese werden in der β-Oxidation in den zahlreichen Mitochondrien metabolisiert. Alternativ können auch Glucose, Ketonkörper und Glykogen in geringerem Umfang abgebaut werden.
ATP-Konzentrationen
In der Zelle ist die ATP-Konzentration eine Regelgröße:
- Absinken unter einen Schwellenwert (4−5 mmol/L) aktiviert energieliefernde Reaktionen (siehe Phosphofructokinase);
- Übersteigen des Schwellenwertes bewirkt Energiespeicherung, z. B. durch
- Bildung von Kreatinphosphat als schnell verfügbaren (ATP-liefernden) Speicher im Muskel;
- Aufbau von Glykogen als „Energiepolster“ in der Leber. Kohlenhydrat- und Proteinspeicher sind allerdings limitiert; weiterer Energieüberschuss führt (über Acetyl-CoA) zur Speicherung von Fett.
Bei einem durchschnittlichen erwachsenen Menschen entspricht die Menge ATP, die täglich in seinem Körper auf- und wieder abgebaut wird, etwa seiner Körpermasse. So verbraucht ein 80 kg schwerer Mann etwa 40 kg ATP am Tag (entspricht etwa 78,8 mol oder 1025 Molekülen), die durch neu gebildete weitere 40 kg ersetzt werden. Der ATP-Durchsatz kann bei intensiver Arbeit auch auf 0,5 kg pro Minute ansteigen.
Literatur
- Reginald H. Garrett, Charles M. Grisham: Biochemistry. 4th edition, international edition. Brooks/Cole, Cengage Learning Services, Boston MA u. a. 2009, ISBN 978-0-495-11464-2.
Einzelnachweise
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ 2,0 2,1 Datenblatt Adenosintriphosphat bei Sigma-Aldrich, abgerufen am 12. Juni 2011.
- ↑ Geschichte des ATP auf der Nobel-Webseite
- ↑ Reginald H. Garrett, Charles M. Grisham: Biochemistry. 4th edition, international edition. Brooks/Cole, Cengage Learning Services, Boston MA u. a. 2009, ISBN 978-0-495-11464-2, S. 849.