Thiosulfate
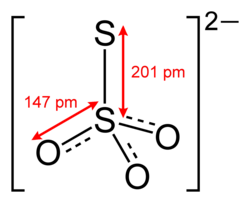

Thiosulfate sind Derivate der im freien Zustand unbeständigen Thioschwefelsäure H2S2O3. Ihre Salze enthalten das Thiosulfat-Anion S2O32−.
Eigenschaften
Wässrige Lösungen von Thiosulfaten sind im basischen stabil. In Gegenwart von Säuren zerfallen sie aufgrund der Unbeständigkeit der freien Thioschwefelsäure in einer Redoxreaktion langsam zu Schwefel, Schwefeldioxid und Wasser:
Mit Eisen(II)-ionen tritt Komplexbildung ein. Diese Reaktion ist gut geeignet, um mit Hilfe von Stoppuhr und Anblick die Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur und der (Stoffmengen-)Konzentration der Reaktionspartner zu demonstrieren.
Verwendung
Das in Chemie und Technik wichtigste Thiosulfat ist das Natriumsalz und Ammoniumsalz, auch Fixiersalz genannt. Es wird in der Fotografie zum Fixieren der belichteten Materialien (Filme, Fotopapier, Farb- und Schwarzweißmaterial) in der Dunkelkammer eingesetzt, da es das unbelichtete und damit unentwickelte Silberbromid als löslichen Dithiosulfatoargentatkomplex auflöst. (Bei Farbmaterial wird auch das reduzierte metallische Silber durch Bleichen entfernt, so dass die Emulsion nach der Verarbeitung silberfrei ist):
Thiosulfat kann dabei u. a. (wie Sulfat) als einzähniger sowie als zweizähnig-chelatbildender Ligand wirken:
Thiosulfat kann auch als Reduktionsmittel für Halogene verwendet werden. Da die entstehenden Halogenidionen weniger umweltgefährdend sind, ist dies eine Möglichkeit, Halogene zu entsorgen. Bei der ablaufenden Reaktion mit Thiosulfat wird die Lösung von beispielsweise Iod entfärbt, wobei Tetrathionat-Ionen und Halogenidionen entstehen:
Diese Reaktion findet bei der Iodometrie, ein Bestimmungsverfahren in der Analytischen Chemie, Anwendung.
Nachweis

In Gegenwart eines Überschusses an Silberionen wird zunächst weißes Silberthiosulfat ausgefällt. Dieses disproportioniert dann zu Sulfid und Sulfat. Die Sulfidionen bilden hierbei mit den Silberionen einen schwarzen Niederschlag, sodass sich der Niederschlag von Silberthiosulfat in einem Farbwechsel von weiß über gelb/orange und braun zu schwarz verfärbt. Dies wird zum Nachweis von Thiosulfationen ausgenutzt und wird auch Abendrotreaktion beziehungsweise Sonnenuntergangsreaktion genannt.
- 1.Schritt: Thiosulfat wird durch Silberionen schnell ausgefällt, es entsteht sofort weißes Silberthiosulfat.
- 2. Schritt: Das Thiosulfat (mittlere Oxidationszahl der Schwefelatome: +II) zerfällt langsam in Verbindungen mit günstigerer Oxidationszahl: Sulfid (−II) und Sulfat (+VI).
Wird hingegen Thiosulfat im Überschuss zugegeben, so reagieren die Silberionen sofort zum oben genannten Dithiosulfatoargentatkomplex.