Decahydrochinolin
| Strukturformel | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||
| Allgemeines | ||||||||||||||||||
| Name | Decahydrochinolin | |||||||||||||||||
| Summenformel | C9H17N | |||||||||||||||||
| CAS-Nummer |
| |||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||||
| Eigenschaften | ||||||||||||||||||
| Molare Masse | 139,24 g·mol−1 | |||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||
| Dichte |
0,93 g·cm−3 (Isomerengemisch, 20 °C)[2] | |||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||
| Siedepunkt | ||||||||||||||||||
| Brechungsindex |
1,4916[2] | |||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||
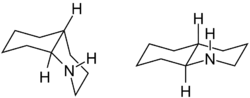
Decahydrochinolin ist eine heterocyclische chemische Verbindung. Sie besteht aus einem Piperidinring mit einem an 2- und 3-Position anelliertem Cyclohexanring. Das Carbocyclische Analogon von Decahydrochinolin ist Decalin.
Decadydrochinolin besitzt zwei Stereozentren, aus denen sich zwei diastereomere Strukturen ergeben. Hierbei handelt es sich um die cis-trans-Isomeren cis- und trans-Decahydrochinolin.
Darstellung
Decahydrochinolin kann durch vollständige Hydrierung von Chinolin hergestellt werden. Die Hydrierung gelingt mit molekularem Wasserstoff in starken Säuren am Platinkatalysator. Hierbei kommt es zunächst nur zur Hydrierung des Benzolrings[4] und nach längerer Reaktionsdauer zur vollständigen Hydrierung zu Decahydrochinolin.[5]
Einzelnachweise
- ↑ Datenblatt Decahydrochinolin bei Acros, abgerufen am 18. Juli 2010.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Datenblatt Decahydroquinoline, mixture of cis and trans bei Sigma-Aldrich, abgerufen am 24. März 2011.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ G. L. Patrick: Synthesis of (±)-[4aα,4bβ,10bβ,12aα]-9-halogeno-2-methyl-1,2,3,4,4a,4b,5,6,10b,11,12,12a-dodecahydronaphtho[2,1-]isoquinolines, in: J. Chem. Soc., Perkin Trans. 1 1995, 1273–1279; doi:10.1039/P19950001273.
- ↑ J. A. Joules, K. Mills: Heterocyclic Chemistry, 5. Auflage, S. 177–199, Blackwell Publishing, Chichester, 2010, ISBN 978-1-4051-9365-8.