Californium(III)-oxid
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
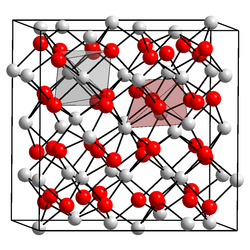
| |||||||
| __ Cf3+ __ O2− | |||||||
| Raumgruppe |
Ia3 | ||||||
| Gitterkonstanten |
a = 1084 pm | ||||||
| Allgemeines | |||||||
| Name | Californium(III)-oxid | ||||||
| Andere Namen |
| ||||||
| Verhältnisformel | Cf2O3 | ||||||
| CAS-Nummer | 12050-91-8 | ||||||
| Kurzbeschreibung |
gelbgrüner Feststoff[1] | ||||||
| Eigenschaften | |||||||
| Molare Masse | 550,157 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Radioaktivität | |||||||
Radioaktiv | |||||||
| Thermodynamische Eigenschaften | |||||||
| ΔHf0 | |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Californium(III)-oxid ist ein Oxid des Elements Californium. Es besitzt die Summenformel Cf2O3. Da alle Isotope des Californiums nur künstlich hergestellt sind, besitzt Californium(III)-oxid keine natürlichen Vorkommen.
Eigenschaften
Californium(III)-oxid ist ein gelbgrüner Feststoff mit einem Schmelzpunkt von 1750 °C[1] und bildet zwei Modifikationen. Die kubisch-raumzentrierte Modifikation bildet ein Kristallgitter mit a = 1083,9 ± 0,4 pm.[4][5] Die Übergangstemperatur zwischen dem kubisch-raumzentrierten und dem monoklinen Cf2O3 beträgt etwa 1400 °C.[6]
Die Bildungsenthalpie bei 25 °C wurde auf −1652,6 ± 10,3 kJ·mol−1 bestimmt.[3]
Verwendung
Seine Anwendung findet es vor allem bei der Herstellung von 252Cf-Neutronenquellen. Dazu wird 252Cf(III) zunächst als Californiumoxalat (Cf2(C2O4)3) gefällt, getrocknet und anschließend zum dreiwertigen Oxid geglüht.[7]
Sicherheitshinweise
Einstufungen nach der Gefahrstoffverordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen und eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielen. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Einzelnachweise
- ↑ 1,0 1,1 1,2 Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie, 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1972.
- ↑ Diese Substanz wurde in Bezug auf ihre Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ 3,0 3,1 Lester R. Morss, J. Fuger, J. Goffart, N. Edelstein, G. V. Shalimoff: „Enthalpy of Formation and Magnetic Susceptibility of Californium Sesquioxide, Cf2O3“, in: Journal of the Less Common Metals, 1987, 127, S. 251–257; doi:10.1016/0022-5088(87)90385-7.
- ↑ J. L. Green, B. B. Cunningham: „Crystallography of the Compounds of Californium. I. Crystal Structure and Lattice Parameters of Californium Sesquioxide and Californium Trichloride“, in: Inorg. Nucl. Chem. Lett., 1967, 3 (9), S. 343–349; doi:10.1016/0020-1650(67)80040-0.
- ↑ J. C. Copeland, B. B. Cunningham: „Crystallography of the Compounds of Californium. II. Crystal Structure and Lattice Parameters of Californium Oxychloride and Californium Sesquioxide“, in: J. Inorg. Nucl. Chem., 1969, 31 (3), S. 733–740; doi:10.1016/0022-1902(69)80020-5.
- ↑ R. D. Baybarz, R. G. Haire, J. A. Fahey: „On the Californium Oxide System“, in: J. Inorg. Nucl. Chem., 1972, 34 (2), S. 557–565; doi:10.1016/0022-1902(72)80435-4.
- ↑ United States Patent 3627691: „A Method of Preparing a Californium-252 Neutron Source“.
Literatur
- Richard G. Haire: Californium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 1499–1576; doi:10.1007/1-4020-3598-5_11.