tert-Butanol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | tert-Butanol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H10O | ||||||||||||||||||
| CAS-Nummer | 75-65-0 | ||||||||||||||||||
| PubChem | 6386 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit campherartigem Geruch[1] | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 74,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
0,776 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
82,5 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
tert-Butanol (auch tert-Butylalkohol oder 2-Methyl-2-propanol) ist der einfachste tertiäre Alkohol.
Gewinnung und Darstellung
Man gewinnt 2-Methyl-2-propanol durch elektrophile Addition von Wasser an Isobuten in Gegenwart von Schwefelsäure als Katalysator:

Bei dieser Reaktion bildet sich fast ausschließlich das 2-Methyl-2-propanol und nicht das isomere 2-Methyl-1-propanol (Isobutanol), da bei der anfänglichen Protonierung des Isobutens durch die Schwefelsäure nur das stabilere tert-Butyl-Kation gebildet wird (Markownikow-Regel).
Eigenschaften
Physikalische Eigenschaften
2-Methyl-2-propanol ist ein bei knapp über Raumtemperatur schmelzender, fester, farbloser Stoff, der charakteristisch campherartig riecht. Die Verbindung ist ein tertiärer Alkohol: Das Kohlenstoff-Atom, das die Hydroxyl-Gruppe trägt, ist an drei weitere Kohlenstoffatome gebunden. Wie alle Butanole ist 2-Methyl-2-propanol brennbar.
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,49774, B = 1174,869 und C = −93,92 im Temperaturbereich von 312,66 bis 355,56 K.[7] Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·e(−αTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 69,085 kJ/mol, α = −0,3583, β = 0,678 und Tc = 506,2 K im Temperaturbereich zwischen 298 K und 385 K beschreiben.[8]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Standardbildungsenthalpie ΔfH0liquid
ΔfH0gas−359,2 kJ·mol−1[9]
−312,6 kJ·mol−1 [9]Standardentropie S0liquid
S0solid189,5 J·mol−1·K−1[10]
170,87 J·mol−1·K−1[11]als Flüssigkeit
als FeststoffVerbrennungsenthalpie ΔcH0liquid −2644,0 kJ·mol−1[12] Wärmekapazität cp 215,37 J·mol−1·K−1 (25 °C)[13]
113,63 J·mol−1·K−1 (25 °C)[14]als Flüssigkeit
als GasKritische Temperatur Tc 506,2 K [15] Kritischer Druck pc 39,7 bar [15] Verdampfungsenthalpie ΔVH0 39,07 kJ·mol−1 [8] beim Normaldrucksiedepunkt
-
Dampfdruckfunktion von tert.-Butanol
-
Temperaturabhängigkeit der Verdampfungswärme von tert.-Butanol
Sicherheitstechnische Kenngrößen
2-Methyl-2-propanol ist ein leicht entzündlicher Feststoff. Die Verbindung hat einen Flammpunkt von 11 °C, das heißt es können sich bereits unterhalb des Schmelzpunktes über festem 2-Methyl-2-propanol entzündliche Dampf-Luft-Gemische bilden.[16] Der Explosionsbereich liegt zwischen 1,7 Vol% (52 g/m3) als untere Explosionsgrenze (UEG) und 8 Vol% (250 g/m3) als obere Explosionsgrenze (OEG).[16] Die Zündtemperatur beträgt 470 °C.[16] Der Stoff fällt somit in die Temperaturklasse T1.
Chemische Eigenschaften
Wie alle aliphatischen Alkohole kann die Hydroxylgruppe des 2-Methyl-2-propanols deprotoniert werden und man erhält das tert-Butylat-Anion. Ein bekanntes und in der organischen Synthesechemie oft verwendetes Salz ist das Kalium-tert-butanolat, das z. B. durch Reaktion von 2-Methyl-2-propanol mit elementarem Kalium zugänglich ist.
Dieses stark basische Salz findet als sterisch anspruchsvolle, aber nur schwach nukleophile Base Anwendung, zum Beispiel bei Deprotonierungen, bei denen die Base nicht nukleophil angreifen darf. Oft verwendet man dann auch 2-Methyl-2-propanol als Lösungsmittel.
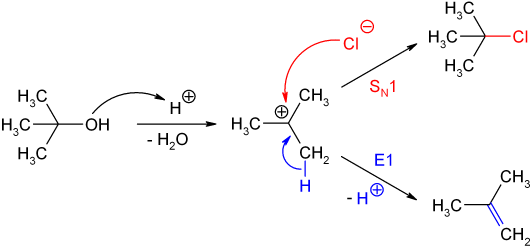
Von starken Protonensäuren (Salzsäure, Schwefelsäure, Phosphorsäure etc.) wird 2-Methyl-2-propanol am Sauerstoffatom protoniert und unter Abspaltung von Wasser bildet sich das tert-Butyl-Kation, das durch den Hyperkonjugationseffekt der drei Methylgruppen stabilisiert ist. In Gegenwart von guten Nukleophilen verläuft die Reaktion im Sinne einer nukleophilen Substitution (SN1) weiter. Beispielsweise bildet sich das 2-Chlor-2-methylpropan (tert-Butylchlorid) sehr leicht aus 2-Methyl-2-propanol und konzentrierter Salzsäure. Sind keine geeigneten Nukleophile zugegen (z. B. bei Verwendung von Schwefelsäure oder Phosphorsäure), so verläuft die Reaktion im Sinne einer Eliminierung (E1) zu 2-Methylpropen (Isobuten). Dies ist die Umkehrung der Herstellung von 2-Methyl-2-propanol.
Verwendung
tert-Butanol wird als Treibstoffzusatz (Antiklopfmittel) verwendet. Weiterhin dient der Alkohol als Ausgangsstoff zur Synthese von tert-Butylestern und tert-Butylphenolen, die wiederum als Antioxidantien eingesetzt werden. Man benutzt es außerdem bei der gaschromatographischen Bestimmung der Blutalkoholkonzentration (Headspace-GC) als internen Standard. Weiterhin wird tert-Butanol als zusätzliches Vergällungsmittel für Trinkalkohol (Ethanol) verwendet.
In der Synthesechemie wird es u. a. auch zur Entsorgung von Resten der Alkalimetalle Kalium und Natrium eingesetzt, da es damit kontrollierbar zu tert-Butanolaten reagiert.
Sicherheitshinweise
2-Methyl-2-propanol kann beim Haut- und Augenkontakt reizend wirken. Beim Einatmen verursacht es weiterhin Husten, dadurch wird es auch vom Körper resorbiert. Bei Verschlucken kann es zu Übelkeit und Erbrechen kommen. Nach der Resorption können Benommenheit, Schwindel, Atemlähmung, Blutdruckabfall und Herz-Kreislaufstörungen auftreten. Deshalb trägt der Stoff das Gefahrensymbol Xn – er ist gesundheitsschädlich. Weiterhin ist er als leichtentzündlich (Symbol F) eingestuft. 2-Methyl-2-propanol ist schwach wassergefährdend (Wassergefährdungsklasse 1).
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 Römpp CD 2006, Georg Thieme Verlag 2006.
- ↑ Datenblatt Tert-Butanol bei Merck, abgerufen am 15. Dezember 2010.
- ↑ 3,0 3,1 3,2 Eintrag zu 2-Methyl-2-propanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. September 2007 (JavaScript erforderlich).
- ↑ 4,0 4,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 75-65-0 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Datenblatt Tert-Butanol bei AlfaAesar, abgerufen am 15. Dezember 2010 (JavaScript erforderlich).
- ↑ Brown, I.; Fock, W.; Smith, F.: The Thermodynamic Properties of Solutions of Normal and Branched Alcohols in Benzene and n-Hexane in J. Chem. Thermodyn. 1 (1969) 273-291.
- ↑ 8,0 8,1 Majer, V.; Svoboda, V., Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, S. 300.
- ↑ 9,0 9,1 Wiberg, K.B.; Hao, S., Enthalpies of hydration of alkenes. 4. Formation of acyclic tert-alcohols in J. Org. Chem. 56 (1991) S. 5108–5110.
- ↑ Parks, G.S.: Kelley, K.K.; Huffman, H.M., Thermal data on organic compounds. V. A revision of the entropies and free energies of nineteen organic compounds in J. Am. Chem. Soc. 51 (1929) S. 1969–1973.
- ↑ Oetting F.L.: The heat capacity and entropy of 2-methyl-2-propanol from 15 to 330 K in J. Phys. Chem. 67 (1963) S. 2757–2761.
- ↑ Skinner, H.A.; Snelson, A.: The heats of combustion of the four isomeric butyl alcohols in Trans. Faraday Soc. 56 (1960) S. 1776–1783.
- ↑ Caceres-Alonso, M.; Costas, M.: Andreoli-Ball, L.; Patterson, D., Steric effects on the self-association of branched and cyclic alcohols in inert solvents. Apparent heat capacities of secondary and tertiary alcohols in hydrocarbons in Can. J. Chem. 66 (1988) S. 989–998.
- ↑ Thermodynamics Research Center, Selected Values of Properties of Chemical Compounds., Thermodynamics Research Center, Texas A&M University, College Station, Texas, 1997.
- ↑ 15,0 15,1 Gude, M.; Teja, A.S.: Vapor-Liquid Critical Properties of Elements and Compounds. 4. Aliphatic Alkanols in J. Chem. Eng. Data 40 (1995) S. 1025–1036.
- ↑ 16,0 16,1 16,2 E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.