2,3-Butandiol
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Strukturformel ohne Stereochemie | |||||||
| Allgemeines | |||||||
| Name | 2,3-Butandiol | ||||||
| Andere Namen |
| ||||||
| Summenformel | C4H10O2 | ||||||
| CAS-Nummer | 513-85-9 (Enantiomerengemisch) | ||||||
| PubChem | 262 | ||||||
| Kurzbeschreibung |
leicht viskose, farblose, fast geruchlose Flüssigkeit[1] | ||||||
| Eigenschaften | |||||||
| Molare Masse | 90,12 g·mol−1 | ||||||
| Aggregatzustand |
flüssig | ||||||
| Dichte |
1,01 g·cm−3[1] | ||||||
| Schmelzpunkt | |||||||
| Siedepunkt |
180 °C[1] | ||||||
| Dampfdruck | |||||||
| Löslichkeit |
mischbar mit Wasser[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| LD50 |
>5000 mg·kg−1 (Ratte, oral)[2] | ||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
2,3-Butandiol ist ein aliphatischer Alkohol mit zwei Hydroxygruppen (–OH) und der Summenformel C4H10O2.
Die Anordnung der Hydroxygruppen kann räumlich unterschiedlich sein. Es existieren daher drei Stereoisomere.
Vorkommen
2,3-Butandiol entsteht z. B. beim Brauvorgang durch Verstoffwechselung des Diacetyl durch die Brauhefe. Obergärige Biere können 50 bis 130 mg/l 2,3-Butandiol enthalten.
Gewinnung und Darstellung
2,3-Butandiol wird unter anderem durch Säurehydrolyse von Maiszucker gewonnen. Mit biotechnologischen Methoden (Umsatz mit Bakterien welche zur gemischten Säuregärung fähig sind, z. B. Enterobacter aerogenes; siehe auch 2,3-Butandiolgärung) lassen sich die einzelnen Enantiomere auch rein darstellen.
Stereoisomerie
2,3-Butandiol ist chiral und enthält zwei gleichsubstituierte stereogene Zentren, es gibt also drei Stereoisomere: (R,R)-2,3-Butandiol [Synonym: D(−)-2,3-Butandiol] und das dazu enantiomere (S,S)-2,3-Butandiol [Synonym: L(+)-2,3-Butandiol] sowie das meso-2,3-Butandiol.
Die physikalischen Eigenschaften wie Schmelz- bzw. Siedepunkt der drei isomeren 2,3-Butandiole unterscheiden sich und variieren bei Gemischen der Isomere mit deren Zusammensetzung.
| 2,3-Butandiole[3] | ||||
| Name | D(−)-2,3-Butandiol | L(+)-2,3-Butandiol | meso-2,3-Butandiol | DL-2,3-Butandiol (Racemat aus D- und L-Form) |
| Strukturformel | 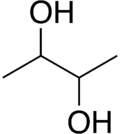
| |||
| Andere Namen | (2R,3R)-2,3-Butandiol | (2S,3S)-2,3-Butandiol | rac-2,3-Butandiol | |
| CAS-Nummer | 24347-58-8 | 19132-06-0 | 5341-95-7 | 513-85-9 |
| Schmelzpunkt | 25 °C | 19,7 °C | 32–34 °C | 7,6 °C |
| Siedepunkt | 180–182 °C | 178–181 °C | 183–184 °C | 182 °C |
| Dichte in g/cm3 | 0,9872 (25 °C) | 0,9869 (25 °C) | 1,0003 (20 °C) | 1,0033 (20 °C) |
| Brechungsindex bei 25 °C | 1,4306 | 1,4340 | 1,4367 | 1,4310 |
| Drehwert [α]D25 °C | +12,5° (unverdünnt) | −13° (unverdünnt) | ±0° | ±0° |
Verwendung
2,3-Butandiol wird zumeist als Ersatz für Glycerin verwendet. Außerdem dient es als Lösemittel, zumeist für Farben und als Ausgangsstoff für die Herstellung von Butadien, Kunststoffen und Epoxidharzen. In Toilettenartikeln wird es als Zusatz in Haarwässern, Haarwasch- und Fixiermitteln sowie in Rasierschaum und Zahnpaste verwendet.[4]
Quellen
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Eintrag zu 2,3-Butandiol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Aug. 2007 (JavaScript erforderlich)
- ↑ Datenblatt 2,3-Butandiol bei Merck, abgerufen am 18. Januar 2011.
- ↑ CRC Handbook of Chemistry and Physics, 60th Edition, CRC Press, 1980.
- ↑ Chemielexikon, Hermann Römpp, Fünfte Auflage, Franckh'sche Verlagshandlung, 1962