Rubidiumamid
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
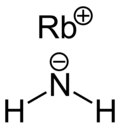
| |||||||
| Allgemeines | |||||||
| Name | Rubidiumamid | ||||||
| Summenformel | RbNH2 | ||||||
| CAS-Nummer | 12141-27-4 | ||||||
| Kurzbeschreibung |
weiße zerfließliche Kristalle[1] | ||||||
| Eigenschaften | |||||||
| Molare Masse | 101,49 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
2,59 g·cm−3[2] | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit |
reagiert mit Wasser[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Rubidiumamid ist eine chemische Verbindung aus Rubidium, Stickstoff und Wasserstoff.
Herstellung
Rubidiumamid bildet sich beim Erwärmen des Metalls im Ammoniakstrom.[1]
Es entsteht auch durch Reaktion von Rubidiumhydrid mit flüssigem Ammoniak unter Wasserstoffentwicklung. Bei Raumtemperatur läuft die Reaktion mit gasförmigem Ammoniak nur sehr langsam ab.[4]
Beim Erwärmen von Rubidiumhydrid im Stickstoffstrom entsteht ebenfalls Rubidiumamid, als Nebenprodukt bildet sich jedoch in nicht unbedeutenden Mengen Rubidiumnitrid.[1]
Eigenschaften
Physikalische Eigenschaften
Rubidiumamid kristallisiert im kubischen Kristallsystem in der Raumgruppe Fm3m mit den Gitterparameter a = 639,5 pm.
Chemische Eigenschaften
Mit Wasser reagiert Rubidiumamid unter Bildung von Ammoniak und Rubidiumhydroxid.[2]
Mit Ethanol bildet sich Rubidiumethanolat und Ammoniak.[2]
Einzelnachweise
- ↑ 1,0 1,1 1,2 R. Abegg, F. Auerbach: 'Handbuch der anorganischen Chemie'. Verlag S. Hirzel, Bd. 2, 1908. S. 430.Volltext
- ↑ 2,0 2,1 2,2 2,3 2,4 Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 688f. (eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Diese Substanz wurde in Bezug auf ihre Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H. Moissan: "Préparation et propriétés des hydrures de rubidium et de césium" in Compt. Rend. Hebd. 1903, 136, S. 587. Volltext