Natriumniobat
| Kristallstruktur | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||
| __ Na+ __ Nb5+ __ O2− | |||||||||||||||
| Allgemeines | |||||||||||||||
| Name | Natriumniobat | ||||||||||||||
| Verhältnisformel | NaNbO3 | ||||||||||||||
| CAS-Nummer | 12034-09-2 | ||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | ||||||||||||||
| Eigenschaften | |||||||||||||||
| Molare Masse | 163,89 g·mol−1 | ||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||
| Dichte |
4,55 g·cm−3 [2] | ||||||||||||||
| Schmelzpunkt |
1422 °C [3] | ||||||||||||||
| Löslichkeit |
unlöslich in Wasser[2] | ||||||||||||||
| Sicherheitshinweise | |||||||||||||||
| |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||
Natriumniobat ist eine chemische Verbindung aus Natrium, Niob und Sauerstoff, vergleichbar Kaliumniobat. Die Verbindung ist wasserunlöslich[2] und wird beim Abkühlen unter −200 °C ferroelektrisch.[6]
Herstellung
Natriumniobat kann durch Festkörper- oder Schmelzenreaktion von Natriumoxid oder -hydroxid mit Niob(V)-oxid gewonnen werden.
Eigenschaften
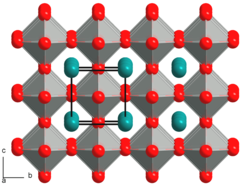
Natriumniobat kristallisiert in einer dem Perovskit vergleichbaren Kristallstruktur. Es geht bei Temperaturänderungen verschiedene Phasenänderungen ein. Es sind insgesamt sieben verschiedene Phasen bei unterschiedlichen Temperaturen bekannt. Bei Raumtemperatur ist eine monokline Kristallstruktur mit den Gitterparametern a = 551 pm;, b = 557 pm, c = 1552 pm sowie β = 89,94° stabil. Unterhalb von −80 °C ist eine rhomboedrische Struktur stabiler, beim Erhitzen über 370 °C wandelt sich die Struktur in eine orthorhombische Kristallstruktur um. Nach zwei weiteren Phasenübergängen bei 480 und 520 °C, bei denen die Orthorhombische Zelle erhalten bleibt, wandelt sich das Kristallsystem bei 575 °C in ein tetragonales um. Die letzte Phasenänderung erfolgt bei 640 °C, oberhalb dieser Temperatur kristallisiert Natriumniobat in einer kubischen Kristallstruktur.[7]
Verwendung
Aufgrund der starken Ausprägung von ferroelektrischen Eigenschaften kann ein Kalium-Natriumniobat zur Herstellung von Piezoaktoren für KfZ-Anwendungen (Common-Rail-Injektoren) verwendet werden. Dies ist von Bedeutung, da bisher Blei-Zirkonat-Titanat (PZT) für solche verwendet wird und Automobile in Zukunft ohne Schwermetalle produziert werden sollen. Ein weiterer Vorteil ist der stark ausgeprägte d33-Effekt (Ausdehnung in Feldrichtung, siehe Piezoeffekt) mit ca. 300 pm/V.
Einzelnachweise
- ↑ Vorlage:Strem
- ↑ 2,0 2,1 2,2 David R. Lide: CRC Handbook of Chemistry and Physics. 87. Auflage. Taylor & Francis, 2007, ISBN 978-0-4893-0487-3.
- ↑ 3,0 3,1 Datenblatt Natriumniobat bei AlfaAesar, abgerufen am 18. Februar 2010 (JavaScript erforderlich).
- ↑ 4,0 4,1 Datenblatt Sodium niobate bei Sigma-Aldrich, abgerufen am 14. April 2011.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Konrad Kopitzki, Peter Herzog: Einführung in die Festkörperphysik. 5. Auflage, Vieweg+Teubner Verlag, 2004, ISBN 3-519-43083-5, S. 235.
- ↑ C. N. W. Darlington, K. S. Knight: On the lattice parameters of sodium niobate at room temperature and above. In: Physica B: Condensed Matter. 1999, 266, 4, S. 368–372, doi:10.1016/S0921-4526(99)00043-5.