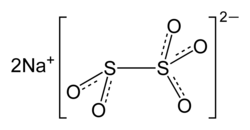
Natriumdisulfit
| Strukturformel | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||
| Allgemeines | |||||||||||||||||
| Name | Natriumdisulfit | ||||||||||||||||
| Andere Namen |
| ||||||||||||||||
| Summenformel | Na2S2O5 | ||||||||||||||||
| CAS-Nummer | 7681-57-4 | ||||||||||||||||
| Kurzbeschreibung |
weißer bis gelblicher kristalliner Feststoff mit stechendem Geruch[1] | ||||||||||||||||
| Eigenschaften | |||||||||||||||||
| Molare Masse | 190,11 g·mol−1 | ||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||
| Dichte |
2,36 g·cm−3 bei 20 °C[2] | ||||||||||||||||
| Schmelzpunkt | |||||||||||||||||
| Löslichkeit |
gut in Wasser (ca. 650 g·l−1 bei 20 °C)[1] | ||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||
| |||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||
Natriumdisulfit, (Na2S2O5) auch Natriumpyrosulfit oder Natriummetabisulfit genannt, ist ein Natriumsalz der in freier Form nicht stabilen Dischwefligen Säure. Disulfite verfügen über eine recht lange, daher wenig stabile Schwefel-Schwefel-Bindung. In Wasser erfolgt daher leicht die Hydrolyse zu Natriumhydrogensulfit:
Beim Erhitzen des Salzes erfolgt eine thermische Zersetzung unter Abspaltung von Schwefeldioxid (SO2):
Synthese
Die Herstellung erfolgt durch thermische Dimerisierung (Kondensation) von Natriumhydrogensulfit unter Abspaltung von Wasser (1), oder durch Umsetzung von Schwefeldioxid und Natriumsulfit in Natronlauge (2):
Verwendung

In der Bundesrepublik Deutschland wird Natriumdisulfit als Lebensmittelzusatzstoff (E 223) vor allem als Konservierungsmittel und Antioxidationsmittel verwendet. Es wird in Trockenfrüchten, bei Meerrettichmasse, Frucht- und Gemüsezubereitungen, Kartoffelgerichten, Fertiggerichten, Fruchtsäften und Marmeladen eingesetzt. Es wird auch in Kombination mit Sorbinsäure und Benzoesäure verwendet.
Natriumdisulfit wird auch als Reduktionsmittel bei der Chemiefaserherstellung, zum Entgiften chromhaltiger Abwässer der Galvanobetriebe sowie in der Fotoindustrie und Bauchemie eingesetzt.
Sonstiges
Natriumdisulfit kann namentlich leicht mit Natriumbisulfit verwechselt werden, einem älteren aber noch gebräuchlichen Namen für Natriumhydrogensulfit.
Gesundheit
Natriumdisulfit wird bei den meisten Menschen in den in Lebensmitteln vorhandenen Konzentrationen schnell durch ein körpereigenes Enzym abgebaut, würde aber sonst zu Übelkeit, Erbrechen, Durchfall und Kopfschmerzen führen.[5] Bei Asthmatikern kann es Sulfitasthma auslösen; außerdem sind allergische und allergieähnliche Reaktionen möglich, wenn auch selten.[5] In Lebensmitteln zerstört Natriumdisulfit Vitamin B1 (Thiamin).[6]
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 Eintrag zu Natriumdisulfit in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30.10.2007 (JavaScript erforderlich)
- ↑ Eintrag zu Natriumdisulfit der BASF (Abgerufen am 2. November 2007)
- ↑ 3,0 3,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 7681-57-4 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ 5,0 5,1 Natriumdisulfit (zusatzstoffe-online.de)
- ↑ E 223 – Natriummetabisulfit; Natriumdisulfit (das-ist-drin.de)