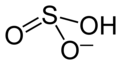
Natriumhydrogensulfit
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumhydrogensulfit | |||||||||||||||
| Andere Namen |
Natriumbisulfit | |||||||||||||||
| Summenformel | NaHSO3 | |||||||||||||||
| CAS-Nummer | 7631-90-5 | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit (existiert nur in Lösung)[1] | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 104,06 g·mol−1 | |||||||||||||||
| Aggregatzustand |
nur in Lösung beständig | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| LD50 |
1540 mg·kg−1 (oral, Ratte)[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Natriumhydrogensulfit (NaHSO3), auch Natriumbisulfit, ist ein Natrium-Salz der Schwefligen Säure. Es ist außerhalb von wässrigen Lösungen nicht stabil.
Darstellung
Eine wässrige Lösung von Natriumdisulfit ergibt Natriumhydrogensulfit.
Schwefeldioxid durch eine Lösung von Natriumcarbonat leiten ergibt ebenfalls Natriumhydrogensulfit.
Eigenschaften
Im Handel befindet es sich als Lösung mit einem zwischen 37 und 50 % liegendem Gehalt an Natriumhydrogensulfit. Diese Lösungen weisen ätzende, reduzierende und stark bleichende Eigenschaften auf. Beim Aufkonzentrieren der wässrigen Lösung entsteht Natriumdisulfit (Na2S2O5) bzw. Natriumsulfit.
Von Bedeutung ist die Additionsreaktion mit Aldehyden oder Ketonen zu sogenannten Hydrogensulfitaddukten (Bisulfitaddukten), wobei sich der Schwefel des Hydrogensulfitions nukleophil an die Carbonylgruppe unter Bildung eines Hydroxyalkylsulfonations anlagert. Als Beispiel ist hier die Reaktion mit Formaldehyd unter Bildung des schwerlöslichen Natriumhydroxymethylsulfonats demonstriert:
Die Hydrogensulfit-Addition wird häufig zur Aufreinigung von Aldehyden oder Ketonen verwendet, da sie unter basischen oder auch sauren Bedingungen reversibel ist.[6]
Verwendung
Als Lebensmittelzusatzstoff E 222 findet Natriumhydrogensulfit Verwendung als Konservierungsmittel, Antioxidationsmittel und als Stabilisator in Lebensmitteln sowie zur Analyse von Methylierungsmustern in DNA.
Einzelnachweise
- ↑ Eintrag zu CAS-Nr. 7631-90-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2008 (JavaScript erforderlich).
- ↑ 2,0 2,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 7631-90-5 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Datenblatt Sodium bisulfite, for analysis, mixture of NaHSO3 and Na2S2O5, powder bei Acros, abgerufen am 8. März 2012.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Datenblatt Natriumhydrogensulfit bei Merck, abgerufen am 23. Juli 2008.
- ↑ Beyer-Walter: Lehrbuch der organischen Chemie, 23. Auflage, S. Hirzel Verlag, Stuttgart 1998.