Bortrichlorid
| Strukturformel | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
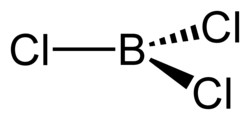
| ||||||||||||||||||
| Allgemeines | ||||||||||||||||||
| Name | Bortrichlorid | |||||||||||||||||
| Andere Namen |
| |||||||||||||||||
| Summenformel | BCl3 | |||||||||||||||||
| CAS-Nummer | 10294-34-5 | |||||||||||||||||
| PubChem | 25135 | |||||||||||||||||
| Kurzbeschreibung |
farbloses Gas[1] | |||||||||||||||||
| Eigenschaften | ||||||||||||||||||
| Molare Masse | 117,17 g·mol−1 | |||||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||||
| Dichte | ||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||
| Siedepunkt |
12,6 °C[1] | |||||||||||||||||
| Dampfdruck | ||||||||||||||||||
| Löslichkeit | ||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||
Bortrichlorid ist eine gasförmige chemische Verbindung aus der Gruppe der Bor-Halogen-Verbindungen bzw. anorganischen Chlorverbindungen.
Gewinnung und Darstellung
Bortrichlorid wird industriell durch direkte Chlorierung von Bortrioxid und Kohlenstoff bei 500 °C gewonnen.[5]
Diese Synthese ist analog zum Kroll-Prozess.
Alternativ ist auch die Synthese direkt aus Borsäure über den Zwischenschritt von Triphenylbor möglich.[5]
Ebenfalls möglich ist eine Direktsynthese aus den Elementen Bor und Chlor.
Eigenschaften
Bortrichlorid ist ein unbrennbares, farbloses, an feuchter Luft durch Bildung von Chlorwasserstoff-Nebel stark rauchendes Gas.
Bei Kontakt mit Wasser reagiert es heftig unter Bildung von Salzsäure und Borsäure:
Bei Erhitzung zersetzt sich die Verbindung, wobei Chlor und Chlorwasserstoff entstehen. Der kritische Punkt liegt bei 178,8 °C, 38,7 bar und 0,790 kg/l; der Tripelpunkt bei −107 °C und 0,373 mbar.[1] Bortrichlorid ist eine Lewis-Säure und reagiert leicht mit tertiären Aminen, Phosphinen, Ethern, Thioethern und Halogenid-Ionen.[6] Es besitzt eine Verdampfungswärme von 203 kJ/kg, spezifische Wärmekapazität von 0,5345 kJ/(kg·K) und eine Wärmeleitfähigkeit von 110·10−4 W/(m·K) (als Gas bei 25 °C und 1 bar Druck).[7]
Verwendung
Bortrichlorid wird als Katalysator, zur Synthese anderer chemischer Verbindungen (z. B. Borazin), für Chlorierungen, zur Beseitigung von Nitriden, Carbiden und Oxiden aus Schmelzen von Aluminium-, Magnesium-, Zinn- und Kupferlegierungen sowie zur Dotierung von Halbleitern verwendet.[1]
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Eintrag zu CAS-Nr. 10294-34-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Juli 2011 (JavaScript erforderlich).
- ↑ Datenblatt Bortrichlorid bei Merck, abgerufen am 1. April 2010.
- ↑ 3,0 3,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 10294-34-5 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ 5,0 5,1 Georg Brauer: Handbuch der präparativen anorganischen Chemie, ISBN 3-432-87813-3.
- ↑ W. Gerrard, M. F. Lappert: Reactions Of Boron richloride With Organic Compounds. In: Chemical Reviews. 1958, 58, S. 1081–1111, doi:10.1021/cr50024a003.
- ↑ Datenblatt (Messer).