Bendamustin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Bendamustin | |||||||||||||||
| Andere Namen |
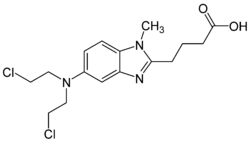
4-[5-[Bis(2-chlorethyl)amino]-1-methylbenzimidazol-2-yl]butansäure | |||||||||||||||
| Summenformel | C16H21Cl2N3O2 | |||||||||||||||
| CAS-Nummer |
| |||||||||||||||
| PubChem | 65628 | |||||||||||||||
| ATC-Code | ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| Wirkstoffklasse |
Zytostatika | |||||||||||||||
| Wirkmechanismus |
Alkylantium | |||||||||||||||
| Verschreibungspflichtig: ja | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 358,26 g·mol−1 | |||||||||||||||
| Löslichkeit |
12,5 g·L−1 in Wasser (20 °C) [1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| LD50 |
40 mg·kg−1 (Ratte) | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Bendamustin (Handelsnamen Ribomustin®, Levact®) ist ein antitumorales Chemotherapeutikum aus der Gruppe der Alkylantien. Innerhalb der Alkylanzien gehört es, wie beispielsweise Chlorambucil und Melphalan, zur Gruppe der N-Lost- oder auch Stickstoff-Lost-Derivate [4] Bendamustin zeichnet sich jedoch durch ein außerordentlich günstiges Nebenwirkungsprofil aus. Haupteinsatzbereich ist die Hämatologie, allein oder in Kombination mit dem monoklonalen Antikörper Rituximab.
Bendamustin wurde in den 1960er-Jahren am Institut für Mikrobiologie und Experimentelle Therapie (IMET) in der ehemaligen Deutschen Demokratischen Republik entwickelt und 1963 von Ozegowski und Krebs beschrieben.[5] Es trug anfänglich die Bezeichnung IMET3393 und kam Ende der 1960er-Jahre als Cytostasan® in den Verkehr. Nach der Wiedervereinigung wurde es 1993 in der Bundesrepublik zugelassen.
Wirkung und Eigenschaften
Bendamustin wirkt durch Alkylierung der Erbsubstanz der Zellen. Die reaktiven Gruppen der Alkylanzien, hier die Bis-(2-chlorethyl)-Partialstruktur, können intrazellulär leicht mit funktionellen Gruppen wie Phosphatgruppen der DNS oder Carbonylgruppen von Proteinen reagieren. Die bedeutendsten Reaktionen im Hinblick auf eine antitumorale Wirkung sind Alkylierungsreaktionen mit DNS- oder RNS-Basen. Es resultieren Mutationen an der DNS und Funktionsstörungen der alkylierten Proteine durch deren chemische Veränderung. Bisfunktionale Alkylanzien wie Bendamustin können Quervernetzungen von DNS und Funktionsproteinen bewirken. Durch die Zerstörung der DNS-Struktur verliert diese ihre Matritzenfunktion und die Replikationsfähigkeit wird aufgehoben. Die Quervernetzung von DNS-Doppelsträngen schädigt insbesondere proliferierende Zellen. Der Zelltod wird in der Folge durch irreversible DNS-Schädigung (DNS- oder Chromosomenstrangbrüche durch misslingende Reparaturversuche) und/oder gestörte RNS- und Proteinbiosynthese bedingt. Damit wird nicht nur die Teilung bez. die Vermehrung unterbunden, die defekte Zelle geht in den programmierten Zelltod, die Apoptose. Allerdings unterscheidet sich Bendamustin in seiner Pharmakodynamik vorteilhaft von anderen Alkylanzien und auch innerhalb der Gruppe der N-Lost-Derivate hinsichtlich Wirksamkeit, Resistenzverhalten von Tumorzellen und auch im Sensitivitätsmuster gegenüber Tumorzelllinien. Im Unterschied bzw. im Vergleich zu anderen Alkylanzien zeigen sich unter Bendamustin mehr DNS-Doppelstrangbrüche als unter Melphalan, Cyclophosphamid oder Carmustin bei äquitoxischen Konzentrationen. Die Reparatur von Bendamustin-induzierten DNS-Strangbrüchen in humanen Mammakarzinomzellen ist, im Vergleich zu den durch Cyclophosphamid oder Carmustin induzierten, scheinbar erschwert und scheint darüber hinaus langsamer zu verlaufen. Bendamustin aktiviert verstärkt den Nukleotid-Exzisions-Reparaturpfad anstelle des Alkyltransferase-Reparaturmechanismus und zeigt noch Aktivität bei ansonsten Alkylanzien-resistenten Tumorzellen bzw. bei Alkylanzien refraktären Tumoren.
Nebenwirkungen
Zu den Besonderheiten von Bendamustin gehört ein außergewöhnlich gutes Nebenwirkungsprofil innerhalb der Alkylanzien und auch innerhalb der Stickstofflost-Gruppe. Für ausnahmslos alle Alkylanzien typisch ist die Myelosuppression. In absteigender Häufigkeit sieht man Neutropenie > Thrombozytopenie > Anämie. Die von den Patienten als belastend angesehene Alopezie ist allerhöchstens minimal oder sie tritt gar nicht auf. Kein Patient erleidet einen kompletten Haarausfall. Eine Nageltoxizität ist nicht beschrieben. Bendamustin ist als moderat emetogen klassifiziert. Zu akutem Erbrechen unter oder binnen 24 Stunden nach der Infusion kommt es selten (sofern kein weiterer, emetogener Kombinationspartner appliziert wird). Allerdings darf die verzögert eintretende Übelkeit nicht unterschätzt werden. Bendamustin wird häufig an zwei aufeinanderfolgenden Tagen ambulant appliziert. Schätzungsweise ein Drittel aller Patienten erleiden trotz Prophylaxe mit einem Setron verzögerte Übelkeit für bis zu einer Woche nach Ende der Bendamustintherapie. Die Patienten sollten daher grundsätzlich mit einem 5-HT3-Antagonisten an jedem Tag einer Bendamustininfusion abgedeckt werden. Kommt es dennoch zu verzögerter Übelkeit, so ist in der Folge eine Prophylaxe mit dem lang wirksamen Palonosetron an Tag 1 der Bendamustintherapie oder die Hinzunahme eines NK1-Antagosisten (derzeit nur Aprepitant) zu empfehlen.
Kinetik und Metabolisierung
Bendamustin verteilt sich unabhängig vom Alter (> 70 Jahre) und vom Tumorstadium schnell in verschiedenste Gewebe (Verteilungshalbwertszeit ca. 7 Minuten). Die Gewebeverteilung ist ungleichmäßig. Die Ausscheidung von Bendamustin erfolgt zu 90 % über die Faeces. Weniger als 10 % werden unverändert im Urin wiedergefunden. Inklusive der Metabolite Monohydroxybendamustin, Dihydroxybendamustin, M 3 und M 4 werden binnen 24 Stunden insgesamt 20 % der verabreichten Dosis als im Urin gefunden. Es kann also unabhängig von der Nierenfunktion dosiert werden. Wie andere N-Loste wird auch Bendamustin an der Bischlorethylpartialstruktur nicht-enzymatisch zu Mono- und Dihydroxybendamustin hydrolysiert. Die aktive Metabolisierung von Bendamustin findet in der Leber statt. Der Phase-I-Metabolismus läuft über Cytochrom P450 Subtypus 1A2 ab (CYP1A2). Aktive Metabolite sind das γ-Hydroxybendamustin (M 3) und das N-Desmethylbendamustin (M 4). Die Plasmakonzentration dieser Metabolite ist 1/10 resp. 1/100 der Muttersubstanz, sodass man davon ausgehen muss, dass dem unveränderten Bendamustin die hauptsächliche zytotoxische Wirkung zukommt (Übersicht [6][7]).
Einsatz
Bendamustin verfügt über eine breite antitumorale Wirksamkeit, sowohl gegen hämatologische als auch gegen solide Tumore. Zu nennende Indikationen sind in erster Linie indolente Non-Hodgkin-Lymphome, Mantelzelllymphome, die chronische lymphatische Leukämie (CLL), das multiple Myelom, aber auch aggressive und Hodgkin-Lymphome sowie Mammakarzinome und kleinzellige Bronchialkarzinome. Hervorzuheben ist dabei, dass mit Bendamustin auch in der Rituximab-refraktären Krankheitssituation – inklusive Resistenzen gegen Alkylanzien – Erfolge erzielt werden. Im direkten Vergleich mit anderen Substanzen allein[8] oder in Kombination mit Rituximab [9][10] verglichen mit anderen Rituximab haltigen Chemotherapien hat sich Bendamustin in kontrollierten Studien als überlegen gezeigt. Zugelassen ist Bendamustin für die Therapie fortgeschrittener indolenter Non-Hodgkin-Lymphome in Kombinationen mit anderen Zytostatika, fortgeschrittener multipler Myelome (Plasmozytom) im Stadium II mit Progress oder Stadium III (nach Salmon und Durie) ebenfalls im Kombinationsprotokoll mit Prednison und für die Chronisch lymphatischen Leukämie [11]. Bendamustin ist auch bei soliden Tumoren wirksam, es fehlt jedoch eine entsprechende Zulassung. Cytostasan® wurde beispielsweise in der DDR auch gegen Mammakarzinome eingesetzt. Im Rahmen des Nachzulassungsverfahrens wurde eine vergleichende Mammakarzinom-Studie, in der das Cyclophosphamid im CMF-Schema (M = Methotrexat, F = 5-Fluorouracil) gegen Bendamustin ausgetauscht wurde, erfolgreich beendet [12]. Die Zulassungsbehörde war jedoch der Ansicht, dass bei einer solchen wichtigen Indikation eine einzelne Studie nicht ausreichend sei. Die Ergebnisse zeigten zwar eine Überlegenheit des BMF-Arms hinsichtlich der Zeit bis zur Progression, allerdings auch eine höhere Toxizität. Die Studie lief zu lange und das CMF-Schema war unter dem Eindruck der vielen neuen Substanzen und Kombinationen in dieser Indikation (Anthrazykline, Taxane, Trastuzumab) zum Zeitpunkt der Einreichung der Unterlagen nicht mehr die optimale Wahl. Eine solche Studie in kurzer Zeit aufzulegen und in vertretbarer Zeit bzw. bis zum Fristende des Nachzulassungsverfahrens zu beenden, war nicht möglich. Daher wurde diese Indikation aufgegeben. Weitere Studien bestätigen aber das Salvagepotenzial von Bendamustin bei dieser Erkrankung [13]. [14]. [15]. Eine weitere Tumorentität, gegen die Bendamustin wirksam ist, ist das kleinzellige Bronchialkarzinom [16].[17][18]. Unwirksam ist Bendamustin bei Melanomen [19], Keimzelltumoren [20], Weichteilsarkomen [21], Plattenepithelkarzinomen im Kopf-Hals-Bereich [22] und hepatozellulären und Gallengangskarzinomen [23]
Weblinks
- Arzneimittel-Kompendium der Schweiz: Bendamustin-Präparate
Einzelnachweise
- ↑ 1,0 1,1 1,2 Sicherheitsdatenblatt Ribomustin, Stand 1. März 2007
- ↑ 2,0 2,1 Datenblatt Bendamustine hydrochloride hydrate bei Sigma-Aldrich, abgerufen am 5. Mai 2011.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Pharma-Wiki (Schweiz): Bendamustin, abgerufen am 20. November 2010
- ↑ Ozegowski W, Krebs D. w-[bis-(chlorethyl)-amino-benzimidazolyl-(2)]-propionic or butyric acids as potential cytostatic agents. J Prakt Chem. 1963;20:178–86
- ↑ Barth, J, Rummel M. Bendamustin – antitumorales N-Lost-Derivat mit klinischen Besonderheiten. Arzneimitteltherapie 2010; 28: 114-122
- ↑ Barth, J, Rummel M. Antitumorale Therapie mit Bendamustin. Krankenhauspharmazie 2010; 31: 393-404
- ↑ Knauf WU, Lissichkov T, Aldaoud A, Liberati A, Loscertales J, Herbrecht R, Juliusson G, Postner G, Gercheva L, Goranov S, Becker M, Fricke HJ, Huguet F, Del Giudice I, Klein P, Tremmel L, Merkle K, Montillo M. Phase III randomized study of bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukemia. J Clin Oncol. 2009 Sep 10;27(26):4378-84.
- ↑ Rummel MJ, Niederle, N., Maschmeyer, G., Banat, G. A., von Gruenhagen, U., Losem, C., Heil, G., Welslau, M., Balser, C., Kaiser, U., Ballo, H., Weidmann, E., Duerk, H., A., Kofahl-Krause, D., Roller, F., Barth, J., Hoelzer, D., Hinke, A., Brugger, W. Bendamustine Plus Rituximab Is Superior in Respect of Progression Free Survival and CR Rate When Compared to CHOP Plus Rituximab as First-Line Treatment of Patients with Advanced Follicular, Indolent, and Mantle Cell Lymphomas: Final Results of a Randomized Phase III Study of the StiL (Study Group Indolent Lymphomas, Germany) Oral Presentation at ASH Annual Meeting. Blood (ASH Annual Meeting Abstracts) 2009;114:168 (Abstract 405).
- ↑ Rummel MJ, Kaiser U, Balser C, Stauch MB, Brugger W, Welslau M, Niederle N, Losem C, Ballo H, Weidmann E, von Gruenhagen U, Mueller L, Sandherr M, Vereschagina J, Hinke A, Barth J. Bendamustine Plus Rituximab Versus Fludarabine Plus Rituximab In Patients with Relapsed Follicular, Indolent and Mantle Cell Lymphomas - Final Results of the Randomized Phase III Study NHL 2-2003 on Behalf of the StiL (Study Group Indolent Lymphomas, Germany) ASH Annual Meeting Abstracts 2010 116: 856
- ↑ Fachinformation Ribomustin, Stand: April 2009
- ↑ von Minckwitz G, Chernozemsky I, Sirakova L, et al. Bendamustine prolongs progression-free survival in metastatic B-Reast cancer (MBC): a phase III prospective, randomized, multicenter trial of bendamustine hydrochloride, methotrexate and 5-fluorouracil (BMF) versus cyclophosphamide, methotrexate and 5-fluorouracil (CMF) as first-line treatment of MBC. Anticancer Drugs 2005;16:871-7.
- ↑ Eichbaum MH, Schuetz F, Khbeis T, et al. Weekly administration of bendamustine as salvage therapy in metastatic B-Reast cancer: final results of a phase II study. Anticancer Drugs 2007;18:963-8.
- ↑ Höffken K, Merkle K, Schonfelder M, et al. Bendamustine as salvage treatment in patients with advanced progressive B-Reast cancer: a phase II study. J Cancer Res Clin Oncol 1998;124:627-32.
- ↑ Reichmann U, Bokemeyer C, Wallwiener D, Bamberg M, Huober J. Salvage chemotherapy for metastatic B-Reast cancer: results of a phase II study with bendamustine. Ann Oncol 2007;18:1981-4.
- ↑ Köster W, Heider A, Niederle N, et al. Phase II trial with carboplatin and bendamustine in patients with extensive stage small-cell lung cancer. J Thorac Oncol 2007;2:312-6.
- ↑ Köster W, Stamatis G, Heider A, et al. Carboplatin in Combination with Bendamustine in Previously Untreated Patients with Extensive-Stage Small Cell Lung Cancer (SCLC). Clin Drug Investig 2004;24:611-8.
- ↑ Schmittel A, Knodler M, Hortig P, Schulze K, Thiel E, Keilholz U. Phase II trial of second-line bendamustine chemotherapy in relapsed small cell lung cancer patients. Lung Cancer 2007;55:109-13.
- ↑ Schmidt-Hieber M, Schmittel A, Thiel E, Keilholz U. A phase II study of bendamustine chemotherapy as second-line treatment in metastatic uveal melanoma. Melanoma Res 2004;14:439-42
- ↑ Kollmannsberger C, Gerl A, Schleucher N, et al. Phase II study of bendamustine in patients with relapsed or cisplatin-refractory germ cell cancer. Anticancer Drugs 2000;11:535-9.
- ↑ Hartmann JT, Mayer F, Schleicher J, et al. Bendamustine hydrochloride in patients with refractory soft tissue sarcoma: a noncomparative multicenter phase 2 study of the German sarcoma group (AIO-001). Cancer 2007;110:861-6.
- ↑ Bottke D, Bathe K, Wiegel T, Hinkelbein W. Phase I trial of radiochemotherapy with bendamustine in patients with recurrent squamous cell carcinoma of the head and neck. Strahlenther Onkol 2007;183:128-32.
- ↑ Schoppmeyer K, Kreth F, Wiedmann M, Mossner J, Preiss R, Caca K. A pilot study of bendamustine in advanced bile duct cancer. Anticancer Drugs 2007;18:697-702.
| Bitte den Hinweis zu Gesundheitsthemen beachten! |