Zinn(IV)-iodid
| Kristallstruktur | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||
| __ Sn4+ __ I− | |||||||||||||||||
| Allgemeines | |||||||||||||||||
| Name | Zinn(IV)-iodid | ||||||||||||||||
| Andere Namen |
| ||||||||||||||||
| Verhältnisformel | SnI4 | ||||||||||||||||
| CAS-Nummer | 7790-47-8 | ||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||
| Eigenschaften | |||||||||||||||||
| Molare Masse | 626,328 g·mol−1 | ||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||
| Dichte | |||||||||||||||||
| Schmelzpunkt | |||||||||||||||||
| Siedepunkt |
364,5 °C[2] | ||||||||||||||||
| Löslichkeit |
Hydrolyse in Wasser[2] | ||||||||||||||||
| Brechungsindex |
2,106[4] | ||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||
| |||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||
Zinn(IV)-iodid ist ein Iodid des Zinns.
Gewinnung und Darstellung
Zinn(IV)-iodid kann durch direkte Synthese aus den Elementen gewonnen werden oder durch Erhitzung einer Zinn(II)-chlorid-Lösung mit Iod gewonnen werden.[6]
Eigenschaften


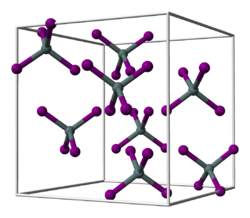
Zinn(IV)-iodid ist ein oranger Feststoff, der in Wasser hydrolysiert. Es bildet eine kubisch-dichte Kugelpackung von Iod-Atomen, in der 1/8 aller tetraedrischen Lücken mit Zinn-Atomen besetzt sind, was zu diskreten, tetraedrischen SnI4-Molekülen führt.[7]
Einzelnachweise
- ↑ Protokoll: Synthese von Zinntetraiodid
- ↑ 2,0 2,1 2,2 2,3 Vorlage:Strem
- ↑ 3,0 3,1 3,2 3,3 Datenblatt Tin(IV) iodide, anhydrous, powder, 99.999% trace metals basis bei Sigma-Aldrich, abgerufen am 9. September 2011.
- ↑ D'Ans-Lax, Taschenbuch für Chemiker und Physiker. Bd 3 (1998) ISBN 3-540-60035-3, S. 740.
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ John C. Bailar: Inorganic Syntheses. 1953, S. 119 (eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007, ISBN 978-3-11-012641-9, S. 970.