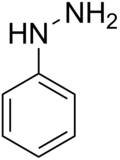
Phenylhydrazin
| Strukturformel | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||
| Name | Phenylhydrazin | |||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||
| Summenformel | C6H8N2 | |||||||||||||||||||
| CAS-Nummer | 100-63-0 | |||||||||||||||||||
| Kurzbeschreibung |
gelblich bis rotbraune Flüssigkeit[1] | |||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||
| Molare Masse | 108,14 g·mol−1 | |||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||
| Dichte |
1,1 g·cm−3[1] | |||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||
| Siedepunkt |
244 °C[1](teilweise Zersetzung) | |||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||
| ||||||||||||||||||||
| LD50 |
188 mg·kg−1 (Ratte, peroral)[1] | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||
Phenylhydrazin ist eine chemische Verbindung aus der Gruppe der Hydrazin-Derivate. Es ist eine gelbliche Flüssigkeit, die sich an Luft zunehmend dunkelrot bis rotbraun färbt.
Geschichte
Phenylhydrazin wurde als erstes Hydrazinderivat durch Emil Fischer im Jahre 1875 untersucht.[5] Er stellte es durch Reduktion von Phenyldiazoniumsalzen mit Sulfitsalzen dar. Fischer nutzte Phenylhydrazin zur Untersuchung der Struktur von Kohlenhydraten durch Bildung von Hydrazonen aus der Aldehydgruppe der Zucker.
Vorkommen
Phenylhydrazin kommt natürlich in einigen Pflanzen (Lorbeerbaum, Leguminosen) vor.[2][6]
Gewinnung und Darstellung
Phenylhydrazin wird kommerziell durch Diazotierung von Anilin mit anschließender Reduktion des Diazoniumkations z. B. durch Natriumsulfit gewonnen.[7] Im Jahr 1998 betrug die Produktionsmenge in Westeuropa 6650 Tonnen.[2]
Eigenschaften
Phenylhydrazin bildet monokline Kristalle und schmilzt bei Raumtemperatur zu einer öligen Flüssigkeit. Es zersetzt sich bei einer Temperatur von mehr als 260 °C und seine Dämpfe sind 3,73 mal schwerer als Luft. Es ist ein starkes Reduktionsmittel und leicht löslich in Wasser.
Verwendung
Phenylhydrazin wird als Zwischenprodukt zur Herstellung von Indolen verwendet, die wiederum Zwischenprodukte für die Synthese verschiedener Farbstoffe, Agrochemikalien und Pharmazeutika sind. Es dient ebenfalls als Ausgangsstoff zur Herstellung von Entwicklern für die Fototechnik.[6]
Weiterhin kann es als Reagenz zum Nachweis bzw. zur Identifizierung von Verbindungen mit Carbonylgruppen dienen[8] (Bildung von Phenylhydrazonen oder Osazonen)[9]. Der Einsatz von Phenylhydrazin als Laborchemikalie (analytische Reagenz für Aldehyde, Ketone und Zucker durch Bildung der gut kristallisierenden Phenylhydrazone oder Osazone, zum Nachweis von Molybdän und anderen Metallen) ist mit einer Derivatisierung verbunden.
Sicherheitshinweise
Phenylhydrazin ist selbstentzündlich, wenn es verunreinigt wird oder in Kontakt mit Stoffen mit großer Oberfläche (z. B. Putzwolle oder Sand) kommt. Seine Dämpfe können beim Erhitzen über seinen Flammpunkt (89 °C) mit Luft ein explosionsfähiges Gemisch bilden. Phenylhydrazin gilt als krebserzeugend, ist ein starkes Blutgift (Methämoglobinbildung) und verursacht auf der Haut Ekzeme.[10] Darüber hinaus führt es zu einer irreversiblen Schädigung des Blutfarbstoffs und der Erythrocyten.[11]
Derivate
- 1-Acetyl-2-phenylhydrazin, CAS: 114-83-0
- Phenylhydrazin·Hydrochlorid C6H8N2·HCl, CAS: 59-88-1
- Phenylhydrazinsulfat, CAS: 52033-74-6
- 2,4-Dinitro-phenylhydrazin
- Phenylhydrazone zum chemischen Nachweis von Carbonylgruppen in Aldehyden und Ketonen
Weblinks
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Eintrag zu CAS-Nr. 100-63-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. November 2007 (JavaScript erforderlich).
- ↑ 2,0 2,1 2,2 Umfangreiches Datenblatt (z.B. mit Nachweismethoden) bei InChem
- ↑ 3,0 3,1 Eintrag aus der CLP-Verordnung zu CAS-Nr. 100-63-0 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Seit 1. Dezember 2012 ist für Stoffe ausschließlich die GHS-Gefahrstoffkennzeichnung zulässig. Bis zum 1. Juni 2015 dürfen noch die R-Sätze dieses Stoffes für die Einstufung von Zubereitungen herangezogen werden, anschließend ist die EU-Gefahrstoffkennzeichnung von rein historischem Interesse.
- ↑ Fischer, E. Über aromatische Hydrazinverbindungen Ber. Dtsch. Chem. Ges., 1875, Band 8, S. 589–594.
- ↑ 6,0 6,1 Datenblatt bei Bundesagentur für Umweltschutz
- ↑ Org. Synth. Coll. Vol. 1, S. 442 (1941); Vol. 2, S. 71 (1922).
- ↑ Bericht über Emil Fischer
- ↑ Reaktionen bioorganischer Verbindungen
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 522, ISBN 3-342-00280-8.
- ↑ Datenblatt bei der Uni Würzburg