Rutherfordsches Atommodell
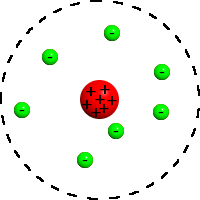
Das rutherfordsche Atommodell ist ein Atommodell, das 1911 von Ernest Rutherford aufgestellt wurde. Es bildet die Grundlage für das heutige Bild vom Atom, indem es den Atomkern als außerordentlich kleine, positiv geladene Kugel im Zentrum des Atoms einführte, die fast dessen ganze Masse vereinigt. Damit korrigierte das rutherfordsche Atommodell das etwas ältere thomsonsche Atommodell und diente seinerseits als Ausgangspunkt des bohrschen Atommodells von 1913, mit dem die Energiestufen der Atomhülle erstmals erfolgreich beschrieben werden konnte.
Entstehung
Vor dem rutherfordschen Streuversuch (1909) von Hans Geiger, Ernest Marsden und Ernest Rutherford war bekannt, dass Atome negativ geladene Elektronen und die gleiche Menge an positiver Ladung enthalten. Einen Erklärungsversuch für den Aufbau der Atome stellte das thomsonsche Atommodell dar. Demnach besteht das Atom aus gleichmäßig verteilten positiven Ladungen und Elektronen, die sich darin bewegen. Der rutherfordsche Streuversuch zeigte, dass die positive Ladung und ein Großteil der Masse in einem Atomkern vereinigt sind und widerlegte damit dieses Atommodell.
Der Versuch
Rutherfords Mitarbeiter (Hans Geiger und Ernest Marsden) führten einen Versuch mit Alpha-Strahlen durch.[1] Als Strahlenquelle diente Radium, das sich in einem Bleiblock befand. Eine Bohrung ließ einen Strom von Alpha-Teilchen austreten, der auf eine dünne Goldfolie traf. Erwartungsgemäß durchdrang der allergrößte Teil der Alpha-Teilchen die Folie ungehindert. Überraschend war, dass wenige Teilchen (ca. 1 von 8.000) beim Durchfliegen der Metallschicht stark abgelenkt und einzelne sogar zurückgeworfen wurden, als ob sie auf ein massives Zentrum im Inneren der Atome gestoßen wären. Dieses massive Zentrum im Inneren des Atoms bezeichnete Rutherford als Atomkern.
„ … es war beinahe so unglaublich, als wenn man mit einer 15-Zoll-Granate auf ein Stück Seidenpapier schießt und die Granate zurückkommt und einen selber trifft.“
– E. Rutherford über das Goldfolienexperiment
Das Modell
Unter Verwendung der nach ihm benannten Streuformel leitete Rutherford aus den Experimenten Werte für die Größe und Ladung der positiven Ladungsverteilung von Gold und anderen Elementen ab. Dabei kam er zu dem Schluss, dass die enorme elektrische Feldstärke, die für die gemessene starke Ablenkung von Alpha-Teilchen erforderlich ist, nur unter der Annahme erklärbar ist, dass die positive Ladung des Atoms vollständig in einem kompakten Atomkern konzentriert ist, dessen Radius um ca. einen Faktor 3000 kleiner als der Atomradius ist.[2]
Zur Erklärung der elektrischen Neutralität von Atomen ging Rutherford davon aus, dass der Atomkern von Elektronen umgeben wird, wobei die Gesamtanzahl der Elektronen pro Atom genau der Kernladungszahl entspricht. Über die räumliche Verteilung der Elektronen ließen sich allerdings aus den Experimenten keine Informationen ableiten, da die Elektronen aufgrund ihrer geringen Masse nicht in nachweisbarem Umfang zur Ablenkung der Alphastrahlen beitragen. Entgegen häufig zu findenden Darstellungen in Lehrbüchern und anderen Sekundärquellen entwickelte Rutherford kein eigenes Modell der elektronischen Struktur von Atomen, er zitierte lediglich im Februar 1911 bei einem Vortrag vor der Manchester Literary and Philosophical Society, der Basis eines im Mai im Philosophical Magazine erschienenen Artikel war,[2] Nagaokas „planetarisches Modell“,[3] um seine Abschätzung der Kernladungszahl von Gold zu plausibilisieren.
Probleme
Ein Problem besteht in der Erklärung von Emission und Absorption von Energiequanten: Mit dem Modell von Rutherford kann keine Erklärung für die so genannten Spektrallinien diverser Gase gegeben werden. Es wird daher durch das bohrsche Atommodell abgelöst, das den Elektronen unterschiedliche Energieniveaus zuordnet.
Ein weiteres Problem, das auch durch das bohrsche Atommodell nicht gelöst werden konnte, besteht darin, dass das Modell keine Erklärung dafür liefert, warum die Elektronen nicht in den Kern stürzen, obwohl kreisende und damit beschleunigte Ladung nach Maxwell ständig Energie abstrahlt. Des Weiteren könnte ein langsam in den Kern stürzendes Elektron Photonen mit jeder beliebigen Frequenz emittieren, was aber, aufgrund der quantisierten Energieniveaus nach , unmöglich ist.
Quellen
- ↑ Hans Geiger, Ernest Marsden: On a Diffuse Reflection of the α-Particles. In: Proceedings of the Royal Society. 82A, 1909, S. 495-500. Abgerufen am 25. Oktober 2010.
- ↑ 2,0 2,1 E. Rutherford, The Scattering of α and β Particles by Matter and the Structure of the Atom, Phil. Mag. 6, vol. 21, 669-688 (1911). Rutherfords Artikel im Philosophical Magazine (englisch, PDF)
- ↑ Hantarō Nagaoka: Kinetics of a system of particles illustrating the line and the band spectrum and the phenomena of radioactivity. In: Philosophical Magazine. 7, 1904, S. 445-455. Abgerufen am 28. Februar 2010.