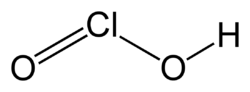
Chlorige Säure
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Allgemeines | |||||||
| Name | Chlorige Säure | ||||||
| Andere Namen |
Chlor(III)-säure | ||||||
| Summenformel | HClO2 | ||||||
| CAS-Nummer | 13898-47-0 | ||||||
| Kurzbeschreibung |
nur in wässriger Lösung stabil[1] | ||||||
| Eigenschaften | |||||||
| Molare Masse | 67,44 g·mol−1 | ||||||
| pKs-Wert |
1,97[1] | ||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Die Chlorige Säure ist eine der sauerstoffhaltigen Säuren des Chlors. Da sie sich auch in verdünnter kalter Lösung rasch in Wasser, Chlordioxid und Salzsäure zersetzt, hat sie in freier Form kaum Bedeutung.
- $ \mathrm {5\,HClO_{2}\rightarrow 4\,ClO_{2}+HCl+2\,H_{2}O} $
Die Salze der Chlorigen Säure sind die Chlorite. Im Gegensatz zur freien Säure sind sie beständiger und können in reiner Form isoliert werden, allerdings sind es reaktionsfähige Stoffe und wirksame Oxidationsmittel, was bei der Handhabung beachtet werden muss.
Herstellung
Man erhält Chlorige Säure durch Umsetzung von Bariumchlorit und Schwefelsäure. Als Nebenprodukt fällt Bariumsulfat aus.
- $ \mathrm {Ba(ClO_{2})_{2}+H_{2}SO_{4}\rightarrow 2\,HClO_{2}+BaSO_{4}} $
Einzelnachweise
- ↑ 1,0 1,1 1,2 Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ Diese Substanz wurde in Bezug auf ihre Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
Weblinks
Chlorsauerstoffsäuren