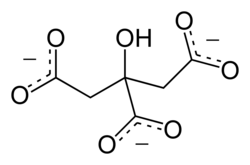
Calciumcitrat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Calciumcitrat | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C12H10Ca3O14 | |||||||||
| CAS-Nummer |
| |||||||||
| ATC-Code | ||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[1] | |||||||||
| Eigenschaften | ||||||||||
| Molare Masse | ||||||||||
| Aggregatzustand |
fest | |||||||||
| Löslichkeit |
sehr schlecht in Wasser (850 mg·l−1 bei 18 °C)[1] und Ethanol[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Calciumcitrat, das Calciumsalz der Citronensäure, ist ein weißer, geruchloser, geschmacksneutraler, kristalliner Feststoff.
Gewinnung und Darstellung
Die Herstellung erfolgt durch Neutralisation von Citronensäure mittels einer Calciumquelle wie Calciumhydroxid. Bei dieser exothermen Fällungsreaktion werden pro Teil Calciumcitrat vier Moleküle Wasser („Kristallwasser“) gebunden.
- Calciumhydroxid und Citronensäure reagieren zu Tricalciumdicitrat und Wasser.
Analog zu dieser Reaktionsgleichung ist Calciumcitrat ein Zwischenprodukt bei der Herstellung von Citronensäure aus Zitrusfrüchten.
Eigenschaften
Calciumcitrat enthält, bezogen auf die Molare Masse des Tetrahydrats C12H10Ca3O14 · 4 H2O, rund 21 % Calcium. Die Wasserlöslichkeit steigt mit sinkender Temperatur (inverse Löslichkeit) und sinkendem pH-Wert. Aufgrund der höheren Löslichkeit im Vergleich zu anorganischen Calciumsalzen wie Calciumcarbonat oder Calciumphosphat, ist die Bioverfügbarkeit des im Calciumcitrats enthaltenen Calciums höher.
Verwendung
Neben dem lange bekannten positiven Einfluss von Calcium auf die Knochendichte (s. Osteoporose), zeigen neuere Untersuchungen, dass bei einer ausreichenden Calciumzufuhr auch das Risiko für Übergewicht und Fettleibigkeit sinkt. Aus diesen Gründen wird Calciumcitrat Nahrungsmitteln zur Calciumanreicherung zugesetzt und für Nahrungsergänzungsmittel (Functional Food) verwendet. Es wird aber auch als Säureregulator und Stabilisator und in Arznei-, Futter- und Zahnpflegemitteln eingesetzt. Es ist in der EU als Lebensmittelzusatzstoff der Nummer E 333 zugelassen.
Vorkommen
Calciumcitrat konnte in Form des sehr seltenen Minerals Earlandit in Tiefseesedimenten der Wedellsee nachgewiesen werden[3].
Einzelnachweise
- ↑ 1,0 1,1 Datenblatt Calciumcitrat bei Merck, abgerufen am 19. Januar 2011.
- ↑ Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ http://www.mindat.org/min-1344.html
Literatur
- Römpp Chemielexikon, 9. Aufl. (Herausgeber: Falbe/Regitz), S. 553
- Kurt Schreier, Hans Wolf: Untersuchungen über den Einfluß der Citronensäure auf den Calciumstoffwechsel. European Journal of Pediatrics, Vol. 67, No. 5 (1950) 526–544
- HJ Heller, LG Greer, SD Haynes, Poindexter JR, and CY Pak: Pharmacokinetic and pharmacodynamic comparison of two calcium supplements in postmenopausal women. Journal of C linical Pharmacology, Vol. 40 (2000) 1237–1244
- Davies KM, Heaney RP, Recker RR, et al: Calcium intake and body weight. Journal of Clinical Endocrinology & Metabolism, Vol. 85, No. 12 (2000) 4635–4638
- Heaney RP, Davies KM, Barger-Lux MJ: Calcium and weight: clinical studies. Journal of the American College of Nutrition, Vol. 21, No. 2 (2002) 152S–155S
- Parikh SJ, Yanovski JA: Calcium intake and adiposity. American Journal of Clinical Nutrition, Vol. 77, No. 2 (2003) 281–287
- Pereira MA, Jacobs DR, Jr., Van Horn L, Slattery ML, Kartashov AI, Ludwig DS: Dairy consumption, obesity, and the insulin resistance syndrome in young adults: the CARDIA Study. JAMA, Vol. 287, No. 16 (2002) 2081–2089
- Zemel MB, Shi H, Greer B, Dirienzo D, Zemel PC: Regulation of adiposity by dietary calcium. Faseb Journal, Vol. 14 (2000) 1132–1138