101. Aldehyde und Ketone - Darstellung, Erkennung, Unterscheidung
Der Weg zu den Aldehyden und Ketonen
Aldehyde
Aldehyde (von alcoholus dehydrogenatus= „dehydrierter Alkohol“ oder „Alkohol, dem Wasserstoff entzogen wurde“) sind chemische Verbindungen mit der funktionellen Gruppe −CHO. Ein Aldehyd macht seit Jahren von sich reden: Das Formaldehyd (sprich: Form-aldehyd). 2004 stufte die Internationale Agentur für Krebsforschung (IARC) der Weltgesundheitsorganisation WHO die Substanz als „krebserregend für den Menschen“ ein.
Die Carbonylgruppe (>C$=$O) der Aldehyde trägt im Unterschied zu den Ketonen einen Wasserstoff- und einen Kohlenstoffsubstituenten. Eine Ausnahme bildet der einfachste Aldehyd Methanal (Formaldehyd), der zwei Wasserstoffsubstituenten trägt. Die von den Alkanen abgeleitete Reihe der Aldehyde bildet die homologe Reihe der Alkanale.
Ketone
Ketone enthalten als funktionelle Gruppe keine endständige Carbonylgruppe (>C$=$O). Eine Ketongruppe [C–C(O)–C] enthält drei Kohlenstoffatome, daher enthalten alle Ketone mindestens drei Kohlenstoffatome.
Ketone kann man als Oxidationsprodukte sekundärer Alkohole verstehen. Die von den Alkanen ableitbaren Ketone nennt man auch Alkanone. Das einfachste Keton ist Aceton.
Darstellung
Primäre, sekundäre und tertiäre Alkohole unterscheiden sich in ihrem Verhalten zu Oxidationsmitteln (Kapitel 96). In Versuch 1 wird der schwarze Belag aus Kupferoxid (CuO) auf einem Kupfernetz zu elementarem Kupfer reduziert (siehe Video). Das Reduktionsmittel ist Ethanol bzw. 2-Propanol.
Oxidation und Reduktion:
Redoxvorgang:
$ \mathrm { \underbrace {CuO}_{\underset {-oxid} {Kupfer}} + \underbrace {CH_3CH_2OH}_{Ethanol} \ \longrightarrow \underbrace {Cu}_{Kupfer} \ + \ \underbrace {CH_3 \; – \ \!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large H} } {\underset {\qquad \diagdown }C }}}}}_{Ethanal} + H_2O } $
Alkanale
Justus von Liebig bezeichnete die funktionelle Gruppe (—CHO) als Aldehydgruppe und die Verbindungen, die sie tragen, Aldehyde. Tatsächlich kann man durch Dehydrierung (Kapitel 82) eines primären Alkohols einen Aldehyd darstellen, das zeigt Versuch 2:
$ \mathrm { H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \ – \ OH \ \longrightarrow \ H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ \!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large H} } {\underset {\qquad \diagdown }C }}}} + 2 \ H }$
Der abgespaltene Wasserstoff reagiert nun mit dem Luftsauerstoff zu Wasser:
$ \mathrm { 2 \ H + \frac {1}{2} O_2 \ \longrightarrow \ H_2O }$
Ethanal
$ \mathrm { H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ \!\!\!\!\!\!\!\!\!\!\!\!\! {\overset { \qquad \ \ \qquad { \Large O}} {\overset {\qquad \ \diagup \!\! \diagup } {\underset {\qquad \qquad {\Large H} } {\underset {\qquad \diagdown }C }}}} }$
$\mathrm {CH_3 \ — \ CHO}$
Propanon
(Aceton)
$ \mathrm { H \ – { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ {\overset {\Large O} {\overset {||} C}} \; – \ { \overset {\Large H} {\overset {|} { \underset {\Large H} {\underset {|}{C}}}}} \; – \ H }$
$\mathrm {CH_3 \ — \ CO \ — \ CH_3}$
$ \mathrm { CuO + \underbrace {CH_3 – CHOH – CH_3}_{2-Propanol} \longrightarrow \ Cu + \underbrace {CH_3 – {\overset {\Large O} {\overset {||} C}} – CH_3}_{Propanon} + H_2O }$
Die Benennung der Aldehyde erfolgt durch Anfügung der Endung -al an den Namen des betreffenden Kohlenwasserstoffs. Chemisch gesehen spricht man bei Aldehyden also von Alkanalen. Die ersten Glieder dieser homologen Reihe sind:
- H—CHO = Methanal = Formaldehyd
- CH3—CHO = Ethanal = Acetaldehyd
- CH3—CH2—CHO = Propanal = Propionaldehyd
Alkanone
In Versuch 3 wurde der sekundäre Alkohol 2-Propanol oxidiert:
$ \mathrm { CH_3 \ – \ CHOH \ – \ CH_3 \ \longrightarrow \ CH_3 \ – \ {\overset {\Large O} {\overset {||} C}} \ – \ CH_3 + 2 \ H }$
Im Gegensatz zu den Alkanalen trägt das Oxidationsprodukt von Versuch 3 an der funktionellen C$=$O -Gruppe kein Wasserstoffatom. Diese funktionelle Gruppe nennt man Carbonylgruppe. Sie ist charakteristisch für die homologe Reihe der Alkanone, die man auch als Ketone bezeichnet. Der einfachste Vertreter dieser Stoffklasse ist das Propanon, das viele besser unter dem gebräuchlichen Namen Aceton kennen. Als Nagellackentferner hat es seine Zeit hinter sich, doch in vielen anderen Bereichen nutzt man es immer noch als Lösungsmittel. Alkanone können durch Dehydrierung sekundärer Alkohole dargestellt werden.
Unterscheidung von Alkanalen und Alkanonen
Zur Unterscheidung von Alkanalen und Alkanonen führt man die so genannte »Schiffsche Probe« durch (Versuch 5). Dabei wird die farblose fuchsinschweflige Säure (Schiffsches Reagenz) durch Spuren von Alkanalen rosa bis violett gefärbt. Die Schiffsche Probe verläuft bei Alkanonen (beispielsweise mit Propanon) negativ.
Die Polarisierung der CO-Gruppe
Sowohl Alkanale als auch Alkanone besitzen besitzen die CO -Gruppe, wodurch beide Stoffarten zahlreiche gemeinsame Eigenschaften besitzen. Beispielsweise lösen sich die niederen Vertreter beider homologer Reihen gut in Wasser. Eine 30-40%ige Lösung von Methanal in Wasser ist als »Formalin« bekannt, das als starkesReduktionsmittel früher zur Keimabtötung verwendet wurde (Formalintabletten). Wie das Wasser sind beide Verbindungsklassen polare Verbindungen.
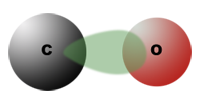
In der Doppelbindung C$=$O zieht nämlich das Sauerstoffatom die Elektronen stärker an als das Kohlenstoffatom. Dieses erhält dadurch eine positive Teilladung, das Sauerstoffatom eine negative. Die Moleküle der Alkanale und Alkanone sind daher Dipol-Moleküle.