Thiolactone

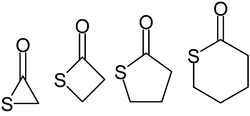
Als Thiolactone bezeichnet man eine Gruppe von Schwefel-haltigen heterocyclischen Verbindungen in der organischen Chemie. Bei den Thiolactonen ist ein Schwefelatom in ein Ringsystem eingebaut, das zusätzlich am benachbarten Kohlenstoffatom eine Carbonylgruppe trägt.
Die Thiolesterbindung des Ringsystems wird dabei zwischen einer Mercapto- (Thiohydroxy-) und einer Carboxygruppe desselben Moleküls unter Austritt eines Wassermoleküles aufgebaut. Thiolactone sind als innere (cyclische) Thiolester mercaptosubstituierter Carbonsäuren aufzufassen. Damit ähneln die Thiolactone den Lactonen, die innere Ester hydroxysubstituierter Carbonsäuren sind.
Vorkommen, Darstellung und Eigenschaften
Während α-Thiolactone nur als instabile Zwischenprodukte bekannt und die β-Thiolactone (Vierringe) nur unter speziellen Bedingungen darstellbar sind, sind die γ- und die δ-Thiolactone (Fünf- bzw. Sechsringe) leicht darstellbar und stabile heterocyclische Verbindungen. γ-Lactone können durch Eindampfen verdünnter wässriger Lösungen der entsprechenden kettenförmigen γ-Mercaptocarbonsäuren erhalten werden. Ein bekanntes chirales Thiolacton ist das Homocystein-Thiolacton (IUPAC: 3-Aminothiolan-2-on). Durch Erhitzen von Methionin mit wässriger Iodwasserstoffsäure wird die Methylgruppe des Methionins abgespalten. Beim Eindampfen entsteht unter Wasserabspaltung als Cyclisierungsprodukt das Hydroiodid von Homocystein-Thiolacton.[1]

Auch beim Erhitzen von Mischungen aus Cystin und Cystein bilden sich verschiedene Thiolactone. Homocysteinthiolactone sind Auslöser von programmiertem Zelltod in Zellkulturen und verursachen chromosomale Schäden. [2]