Keratine
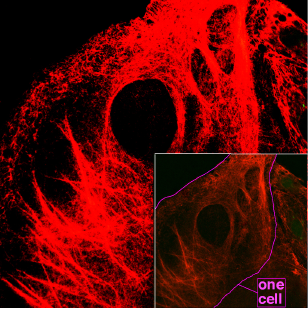
Keratin (von griech. kéras „Horn“, Genitiv kératos) ist ein Sammelbegriff für verschiedene wasserunlösliche Faserproteine, die von menschlichen oder tierischen Organismen gebildet werden und die Hornsubstanz charakterisieren. Entsprechend ihrer molekularen Konformation als α-Helix oder β-Faltblatt unterscheidet man α- und β-Keratine.
Keratine sind der Hauptbestandteil von Säugetierhaaren, Finger- und Zehennägeln, Krallen, Klauen, Hufen, Hörnern, Nasenhörnern der Nashörner, Stacheln der Igel, Barten der Wale, Schnäbeln und Federn der Vögel, Hornschuppen und äußere Panzerbedeckung der Reptilien.
Struktur und Eigenschaften
Ihre Faserstruktur verstärkt die Festigkeit der Keratine: Die einzelnen Aminosäureketten bilden eine rechtsgängige α-Helix. Zwei dieser Helices lagern sich zu einer linksgängigen Superhelix und zwei dieser Superhelices beim α-Keratin zu einer Protofibrille zusammen. Mehrere Protofibrillen vereinigen sich zu einer Mikrofibrille, diese lagern sich zu Bündeln zusammen und bilden Makrofibrillen aus. Die Fasern sind umso steifer, je stärker ihre Komponenten durch Disulfidbrücken der Aminosäure L-Cystein quervernetzt sind. So enthält das Keratin in Hörnern und Klauen mehr Disulfidbrücken als das in Wolle und Haaren.
Vor der Verhornung sowie allgemein in Epithelien der Wirbeltiere und anderer Tiergruppen liegen α-Keratine (oder Cytokeratine) in Form lose organisierter Keratinfilamente vor. Diese gehören zu den Intermediärfilamenten, die zusammen mit Mikrotubuli und Mikrofilamenten das Zytoskelett der eukaryotischen Zellen bilden. Derzeit sind 20 Cytokeratin-Proteine bekannt (siehe Tabelle), deren Molekülmasse zwischen 40 und 68 kDa liegt. CK1 bis CK8 werden zur neutral-basischen Typ-A-Subfamilie, CK9 bis CK20 zur sauren Typ-B-Subfamilie gezählt. Diese bilden paarweise in den Intermediärfilamenten einen Heterodimer-Komplex aus einem Typ-A- und einem Typ-B-Cytokeratin. Die Verteilungsmuster dieser Komplexe unterscheidet sich in verschiedenen epithelialen Zellen erheblich, sodass mit einem Antikörpernachweis gegen die Subtypen CK1 bis CK20 die Herkunft dieser Zellen eingegrenzt werden kann. Dies macht man sich in der Medizin in der pathologischen Diagnostik zunutze, um die Herkunft von Tumormetastasen zu bestimmen. Mutationen in verschiedenen Keratin-Genen sind für eine Reihe seltener Erbkrankheiten (Ichthyose) verantwortlich.
| A (neutral- basisch) |
B (sauer) |
Vorkommen | Pathologie |
|---|---|---|---|
| CK1, CK2 | CK9, CK10 | mehrschichtig-verhornendes Epithel (Epidermis) | Ichthyosis hystrix Typ Curth-Macklin; bullöse kongenitale ichthyosiforme Erythrodermie Brocq (EHK); keratosis palmoplantaris striata III; weitere Ichthyosen (BCIE; AEI; CRIE) |
| CK3 | CK12 | Hornhaut (Cornea) | Korneale Dystrophie |
| CK4 | CK13 | mehrschichtig-unverhorntes Epithel | Naevus spongiosus albus |
| CK5 | CK14, CK15 | Basalzellen komplexer Epithelien sowie Myoepithelzellen | Epidermolysis bullosa simplex; Morbus Dowling-Degos; Naegeli-Syndrom |
| CK6A | CK16, CK17 | mehrschichtig-unverhorntes Plattenepithel, Proliferation | Pachyonychia congenita; div. Nävus, Keratoderma |
| CK7 | CK19 | einschichtiges Epithel, luminale Drüsenzellen | |
| CK8 | CK18, CK20 | einschichtiges Epithel, luminale Drüsenzellen |
Ein Beispiel für ein β-Keratin ist das Fibroin oder Seidenprotein der Spinnennetze und der Seide. Im Unterschied zu den α- oder Cytokeratinen ist es kein intrazelluläres Strukturprotein, sondern ein Ausscheidungsprodukt der Spinndrüsen. Wegen seiner Faltblattstruktur ist es sehr viel weniger dehnbar als die helikal gebauten α-Keratine.
Technische Verwendung
Aus keratinhaltigen Naturstoffen werden L-Cystein, L-Tyrosin und andere proteinogene Aminosäuren im technischen Maßstab hergestellt. Dazu werden die Naturstoffe zuerst mit Salzsäure hydrolysiert. Das Hydrolysat wird mit Ammoniak neutralisiert. Die L-Aminosäuren werden dann aufgrund ihrer unterschiedlichen Löslichkeiten abgetrennt oder nach dem Prinzip der Ionenaustausch-Chromatographie isoliert.[1]
Verwendung finden Keratinprodukte (z. B. Schafwollvliese[2]) beim Abbau von Formaldehyd. Hier hat das deutsche Wollforschungsinstitut an der RWTH Aachen zusammen mit dem eco Institut Köln in langfristiger Forschungsarbeit den Nachweis erbracht, dass solche Produkte in der Lage sind, Formaldehyd aus der Raumluft zu entfernen. Formaldehydbelastete Kindergärten, Schulen und Privathäuser (viele Fertighäuser der 1970er- und 1980er-Jahre) wurden in den letzten Jahren auf diese Weise bereits saniert.[3]
Einzelnachweise
- ↑ Bernd Hoppe, Jürgen Martens: Aminosäuren - Herstellung und Gewinnung, Chemie in unserer Zeit, 1984, 18, 73-86.
- ↑ http://www.wecobis.de/jahia/Jahia/Home/Bauproduktgruppen/Daemmstoffe/aus_nachwachsenden_Rohstoffen/Schafwolle-Daemmstoffe.
- ↑ http://www.oebag.de/fileadmin/downloads/Dateien_all_User/MORRIS_neu.pdf.