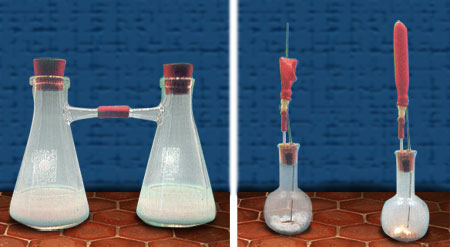
8. Reaktionen und Teilchenmodell
Synthese, Analyse und das Dalton-Modell
Um die Reaktionstypen Analyse und Synthese zu erklären, kann man das Dalton-Modell anwenden.
In der Verbindung Quecksilberoxid sind die Quecksilber- und Sauerstoffatome in einer charakteristischen räumlichen Anordnung miteinander verbunden. Wird erhitzt, dann löst sich dieser Zusammenhalt und es es bilden sich aus zwei Sauerstoffatomen sofort Sauerstoffmoleküle, die aus dem Reagenzglas entweichen. Zwar können auch Quecksilberatome entweichen, doch der Großteil der Quecksilberatome bilden an der Wand des Reagenzglases flüssiges Quecksilber.
Bei der Synthese von Eisen- oder Zinksulfid werden aus den jeweiligen Metallen durch das Erhitzen Eisen- bzw. Zinkatome frei, aus dem Schwefel Schwefelatome, die nun mit den Metallatomen Verbindungen eingehen. So entsteht Eisen- bzw. Zinksulfid.
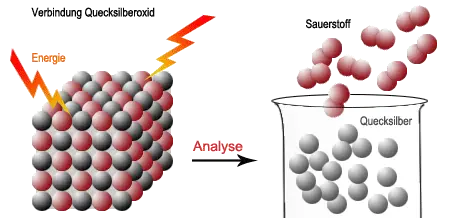
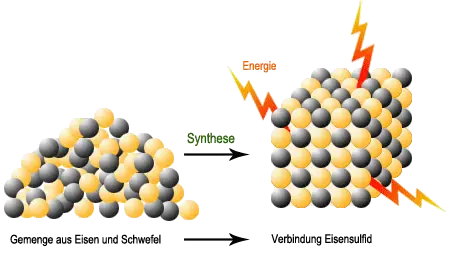
Analyse und Synthese beruhen also auf der Trennung bzw. Verbindung verschiedenartiger Atome.Bei diesen Vorgängen wird Energie entweder freigesetzt oder verbraucht.
Die Erhaltung der Masse
Wie man bei den Versuchen beobachten konnte, ändert sich während einer chemischen Reaktion die Gesamtmasse der Reaktionspartner nicht. Der französiche Chemiker A. L. Lavoisier (1743-1794) erkannte als Erster die Bedeutung dieser Beobachtung und formulierte daraufhin das Gesetz von der Erhaltung der Masse: Die Gesamtmasse ändert sich bei allen chemischen Reaktionen nicht. 1789 stellte er das Prinzip der Massenerhaltung fest:
„Nichts wird bei den Operationen künstlicher oder natürlicher Art geschaffen, und es kann als Axiom angesehen werden, dass bei jeder Operation eine gleiche Quantität Materie vor und nach der Operation existiert.“
– Antoine Laurent de Lavoisier
Lavoisier wurde somit der Begründer der Stöchiometrie, der chemischen Mathematik, die später von Jeremias Benjamin Richter durch das Erkennen des mathematischen Zusammenhanges bei Salzbildungen verbessert wurde.