Afutuzumab
| Obinutuzumab | ||
|---|---|---|
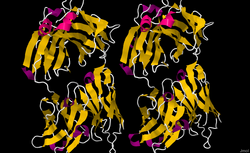
| Zwei identische Dimere des GA101-Fab-Fragments (Mus musculus) als Bändermodell, nach PDB 3PP3 | ||
| Vorhandene Strukturdaten: 3PP3 | ||
| Masse/Länge Primärstruktur | 146 kDa | |
| Bezeichner | ||
| Externe IDs | CAS-Nummer: 949142-50-1 | |
| Arzneistoffangaben | ||
| ATC-Code | kein | |
| Wirkstoffklasse | Zytostatikum, monoklonaler Antikörper | |
Obinutuzumab[1] (GA101, R05072759, alte Bezeichnung Afutuzumab, HuMab CD20) ist ein neuer humaner monoklonaler Antikörper, der zur Therapie eines wiederkehrenden und therapieresistenten Non-Hodgkin-Lymphoms (NHL) eingesetzt werden kann. Allerdings fehlt noch die Zulassung, weil die Zulassungsstudie noch nicht abgeschlossen ist.
Wirkungsweise
GA101 (Obinutuzumab) wirkt ähnlich wie Rituximab und Ofatumumab als CD20-Antikörper. Dieser Wirkstoff ist der erste monoklonale CD20-Antikörper der 2. Generation, der mit der Technik des sogenannten Glykoengineering (Glykosylierung), optimiert wurde. Dadurch kann die Vernichtung von bösartigen B-Lymphozyten durch die Aktivierung anderer Immunzellen gegen die Krebszellen oder die direkte Auslösung des Zelltodes verbessert werden.
Anwendung
GA101 (Obinutuzumab) kann bei Patienten mit einem indolenten Non-Hodgkin-Lymphom oder einer therapieresistenten Chronisch Lymphatischen Leukämie, die stark vorbehandelt sind, eingesetzt werden. In einer Phase-I und Phase-II-Studie sprachen selbst Patienten auf die Behandlung an, bei denen Rituximab keine Wirkung mehr zeigte. Das Präparat wird zurzeit in einer Reihe von Phase-III-Studien, unter anderem auch im direkten Vergleich mit Rituximab, geprüft.
Dosierung
In einer Phase-III-Studie der Deutschen CLL Studiengruppe wird GA101 mit Chlorambucil kombiniert: 1000 mg GA101 intravenös an den Tagen 1, 8 und 15 (Zyklus 1) und Tag 1 (Zyklus 2 - 6) + 0.5 mg Chlorambucil/kg Körpergewicht oral an den Tagen 1 und 15.
Weblinks
- Medienmitteilung Roche, Stand 12/2010
- American Society of Hematology (ASH), Stand 12/2010
- Deutsche CLL Studiengruppe
- American Medical Assoziation