Nicotinsäure
| Strukturformel | ||||
|---|---|---|---|---|
| Allgemeines | ||||
| Trivialname |
| |||
| Andere Namen |
| |||
| Summenformel | C6H5NO2 | |||
| CAS-Nummer | 59-67-6 | |||
| PubChem | 938 | |||
| ATC-Code | ||||
| DrugBank | DB00627 | |||
| Kurzbeschreibung | farblose Kristalle[1] | |||
| Vorkommen | Geflügel, Leber, Kaffee, Bierhefe | |||
| Physiologie | ||||
| Funktion | Bestandteil der Coenzyme NADH und NADPH | |||
| Täglicher Bedarf | 15–20 mg | |||
| Folgen bei Mangel | leicht: Reizbarkeit, Appetitlosigkeit, Konzentrations- und Schlafstörungen schwer: Pellagra | |||
| Überdosis | über 1,5–3 g pro Tag | |||
| Eigenschaften | ||||
| Molare Masse | 123,11 g·mol−1 | |||
| Aggregatzustand | fest | |||
| Dichte | 1,47 g·cm−3[2] | |||
| Schmelzpunkt | 236,6 °C[2] | |||
| pKs-Wert | ||||
| Löslichkeit | löslich in Wasser: 18 g·l−1 (20 °C)[2] | |||
| Sicherheitshinweise | ||||
| GHS-Gefahrstoffkennzeichnung [2]
Achtung | ||||
| H- und P-Sätze | H: 319 | |||
| P: 305+351+338 [2] | ||||
Gefahrstoffkennzeichnung [2]
| ||||
| R- und S-Sätze | R: 36 | |||
| S: 22-26 | ||||
| LD50 | ||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||
Nicotinsäure (auch: Niacin) ist ein Vitamin aus dem B-Komplex. Die Bezeichnungen Vitamin B3, seltener PP-Faktor (Pellagra-Preventing-Faktor) für Nicotinsäure gilt heute als veraltet und überholt. Die Nicotinsäure wurde 1867 bei der Oxidation von Nicotin entdeckt[6]; ihre physiologische Wirksamkeit wurde 1934 erkannt[7]. Die Nicotinsäure (Pyridin-3-carbonsäure) ist eine organische Verbindung, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Sie bestehen aus einem Pyridinring, der mit einer Carboxygruppe (−COOH) substituiert ist. Sie gehört mit den anderen beiden Isomeren Picolinsäure und Isonicotinsäure zur Stoffgruppe der Pyridincarbonsäuren mit der Summenformel C6H5NO2.
Vorkommen/Eigenschaften
Nicotinsäure findet sich in allen lebenden Zellen und wird in der Leber gespeichert. Es bildet einen wichtigen Baustein verschiedener Coenzyme (NAD, NADP) und ist in dieser Form von zentraler Bedeutung für den Stoffwechsel von Eiweißen, Fetten und Kohlenhydraten. Gegenüber Hitze, Licht und dem Luftsauerstoff ist Nicotinsäure weniger empfindlich als andere Vitamine der B-Gruppe.
Nicotinsäure ist ein kristalliner Feststoff. Es tritt in zwei polymorphen Formen auf. Bei Raumtemperatur liegt die Kristallform II vor. Beim Aufheizen auf 178,8 °C wird eine schwach endotherme Festphasenumwandlung mit ΔfusH = 0,81 kJ/mol zur Kristallform I beobachtet. Diese schmilzt dann bei 236,6 °C mit einer Schmelzenthalpie von ΔfusH = 27,57 kJ/mol.[8]
Von der Nicotinsäure leitet sich namentlich die Dinicotinsäure (Pyridin-3,5-dicarbonsäure) ab, die am Pyridin achsensymmetrisch zwei Carboxygruppen trägt.
Synthese/Herstellung
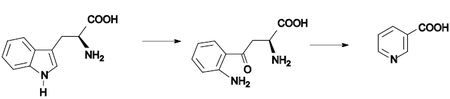
Nicotinsäure bildet sich durch Oxidation von Nicotin mittels Salpetersäure.[9] Alternativ kann es aus Chinolin durch Oxidation mittels Kaliumpermanganat (KMnO4) dargestellt werden, wobei als Zwischenprodukt Chinolinsäure entsteht:[9]
Schließlich erhält man Nicotinsäure auch durch Oxidation von 3-Picolin mit Kaliumpermanganat:[10]
Von Bedeutung ist heute lediglich die Oxidation von 5-Ethyl-2-methyl-pyridin (MEP) mittels Salpetersäure.[11]
Biosynthese
Über die Biosynthese der Nicotinsäure in Pilzen und Pflanzen ist wenig bekannt, insbesondere die beteiligten Enzyme. Am wahrscheinlich häufigsten ist der oxidative Abbau von Tryptophan über Kynurenin zur Nicotinsäure anzutreffen.[12]
Dieser Weg spielt jedoch im Menschen keine Rolle, da der eigentliche Zweck des Niacins, die Biosynthese von NAD, auch mit dem Tryptophan-Abbauprodukt Chinolinsäure funktioniert.[13][14]
Aufgabe/Funktion
Nicotinsäure ist am Eiweiß-, Fett- und Kohlenhydratstoffwechsel beteiligt. In Form der Coenzyme NAD/NADP und ihrer reduzierten Formen NADH + H+ NADPH + H+, der sogenannten Reduktionsäquivalente, ist die Nicotinsäure z. B. am Citratzyklus und der Atmungskette beteiligt. Sie hat eine antioxidative Wirkung und nimmt an vielen enzymatischen Vorgängen teil. Nicotinsäure ist wichtig für die Regeneration von Haut, Muskeln, Nerven und DNA.
Vorkommen und Bedarf
Natürliche Lieferanten von Nicotinsäure sind Nahrungsmittel wie Geflügel, Wild, Fisch, Pilze, Milchprodukte und Eier. Auch Leber, Kaffee, Cashew-Kerne, Vollkornprodukte, verschiedene Gemüse und Obst enthalten Nicotinsäure, wobei es aus tierischen Produkten grundsätzlich besser vom Organismus verwertet wird. Veganer können ihren Bedarf beispielsweise aus Erdnüssen, Weizenkleie, Datteln, Champignons, Bierhefe, getrockneten Aprikosen und Hülsenfrüchten decken.[15]
Der tägliche Nicotinsäure-Bedarf des Körpers hängt vom Energiebedarf ab. Im Durchschnitt benötigt der erwachsene Körper etwa 6,6 Milligramm Niacin, um eine Energiemenge von 1000 Kilokalorien für seine Zellen, Gewebe und Organe zu erzeugen. Damit beträgt der Bedarf für Frauen 13 bis 15 mg Nicotinsäure pro Tag, für Männer 15 bis 20 mg pro Tag.
Bei Milchkühen wird Niacin als Futtermittelzusatz verwendet. Hier sorgt es für eine ausgeglichenere Energiebilanz.[16]
Mangelerscheinungen (Hypovitaminose)
Mangelsymptome treten selten auf, da der Körper NAD nicht nur aus Niacin, sondern auch aus der Aminosäure Tryptophan bilden kann. Durch eine eiweißarme Ernährung oder durch Absorptionsstörungen kann es zunächst zu unspezifischen Störungen wie Appetitlosigkeit, Konzentrations- und Schlafstörungen sowie einer gewissen Reizbarkeit kommen. Symptome bei Nicotinsäuremangel sind weiterhin:
- Hautveränderungen Dermatitis
- Durchfall
- Depressionen
- Entzündung der Mund- und Magen-Darm-Schleimhäute
- Krankheit: Pellagra
Das Auftreten der Pellagra-Krankheit steht im Zusammenhang mit der Einführung des Maises außerhalb Mittelamerikas, der wenig Tryptophan enthält. In seinem Ursprungsland Mexiko wird der Mais bis heute nach der Ernte üblicherweise in alkalisches Kalkwasser gelegt und nass vermahlen, wodurch die Nicotinsäure im Mais erst freigesetzt wird. Von den spanischen Eroberern wurde der Mais nach Südeuropa, Nordamerika und Afrika gebracht, ohne diese Zubereitungstechnik zu übernehmen. Wegen der höheren Erträge stellten sich viele Bauern schon bald von Weizen und Gerste auf Mais um. Die Folge war, dass bei ganzen Bevölkerungsschichten, bei denen Mais die Hauptnahrungsquelle war, Nicotinsäure- und Tryptophan-Mangelerscheinungen auftraten. Erst Anfang des 20. Jahrhunderts wurde der Zusammenhang von Pellagra und Maisernährung aufgeklärt.
Folgen einer Überdosierung (Hypervitaminose)
Von einer Überdosierung spricht man bei der Nicotinsäure bei 1,5–3 g Dosierung pro Tag. Bei einer Zufuhr von über 500 mg pro Tag, in Einzelfällen auch weniger, kommt es zum hautgefäßerweiternden Effekt Flush und bei einer Menge von über 2500 mg pro Tag können Blutdruckabfall, Schwindelgefühle und ein erhöhter Harnsäuregehalt im Blut auftreten.
Nicotinsäure als Medikament
Nicotinsäure (Internationaler Freiname) wird zur Absenkung erhöhter Blutfettwerte eingesetzt, wenn eine alleinige Therapie mit Statinen nicht ausreichend ist. Dabei senkt Nicotinsäure das LDL-Cholesterin, Lp(a) und die Triglyzeride und es erhöht das HDL-Cholesterin. Eine Flush-Symptomatik kann therapielimitierend sein. Man kann ihr jedoch mit Acetylsalicylsäure oder Laropiprant entgegenwirken, da diese beiden Wirkstoffe die gefäßdilatierende Wirkung der hierbei eine Rolle spielenden Prostaglandine unterbinden. Häufig sind auch Magen-Darm-Beschwerden. Die längere Einnahme von hochdosierten Nicotinsäurepräparaten kann die Glucosetoleranz verschlechtern und die Harnsäurewerte im Blut erhöhen. Studien, die einen lebensverlängernden Effekt von Nicotinsäure beweisen, existieren bisher nicht. Ebenfalls Auswirkungen auf die Blutfettwerte hat der von der Nicotinsäure abgeleitete Nicotinylalkohol.
Handelsnamen
Monopräparate
- Niaspan. Abbott stellt die Produktion des Produktes Niaspan (Nicotinsäure-Retardtabletten) ein.[17] Einige Dosierungen sind schon abverkauft, andere noch verfügbar (Stand 29. Juni 2011). Die National Institutes of Health (NIH) stoppten Ende Mai 2011 eine groß angelegte Niaspan-Studie mit über 3400 Patienten, die parallel zu dem Statin Simvastatin Niaspan erhielten. Niaspan konnte die Rate an Herzanfällen nicht senken. Dagegen stieg die Anzahl an Schlaganfällen bei den Patienten, die zusätzlich Niaspan erhielten, leicht an.[18][19]
Kombinationspräparate
- Tredaptive (mit Laropiprant)
Einzelnachweise
- ↑ Hermann Römpp, Jürgen Falbe und Manfred Regitz: Römpp Lexikon Chemie, 9. Auflage, Georg Thieme Verlag, Stuttgart 1992.
- ↑ 2,0 2,1 2,2 2,3 2,4 Eintrag zu CAS-Nr. 59-67-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. Juni 2011 (JavaScript erforderlich).
- ↑ 3,0 3,1 Zvi Rappoport: CRC Handbook of Tables for Organic Compound Identification, Third Edition, CRC Press, Boca Raton Florida 1984, ISBN 0-8493-0303-6, S. 432.
- ↑ Datenblatt Nicotinsäure bei Carl Roth, abgerufen am 2. März 2010.
- ↑ Nicotinsäure bei ChemIDplus.
- ↑ L. F. Fieser und M. Fieser: Organische Chemie, Verlag Chemie, Weinheim 1965, S. 1675–1676.
- ↑ J. G. Wooley, W. H. Sebrell: „Niacin (Nicotinic Acid), an Essential Growth Factor for Rabbits [...]“, Division of Physiology, National Institute of Health, U.S. Public Health Service, Bethesda, Maryland, 1944.
- ↑ S. X. Wang, Z. C. Tan, Y. Y. Di, F. Xu, M. H. Wang, L. X. Sun, T. Zhang: „Calorimetric study and thermal analysis of crystalline nicotinic acid“, in: J. Therm. Anal. Calorim., 2004, 76, S. 335–342; doi:10.1023/B:JTAN.0000027833.24442.a0.
- ↑ 9,0 9,1 Andrew Streitwieser, Clayton H. Heathcock und Edward M. Kosower: Organische Chemie, 2. Auflage, Wiley-VCH, Weinheim 1994, ISBN 3-527-29005-2, S. 1227.
- ↑ Harold Hart (Autor), Leslie E. Craine (Autor), David J. Hart (Autor), Christopher M. Hadad (Autor); Nicole Kindler (Übersetzer): Organische Chemie, 3. Auflage, Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8, S. 494.
- ↑ Detlef Gerritzen: Ökonomie und Ökologie im Einklang – nachhaltige chemische Produktion am Beispiel des Lonza-Produktionsverbundes in Visp, 7. Freiburger Symposium 2005, Nachhaltige chemische Produktion; PDF.
- ↑ J. B. Tarr, J. Arditti: „Niacin Biosynthesis in Seedlings of Zea mays“, in: Plant Physiol., 1982, 69 (3), S. 553–556; PMID 16662247; PMC 426252.
- ↑ R. Jacob, M. Swenseid: „Niacin“, in: E. E. Ziegler, L. J. Filer (Hrsg.): Present Knowledge in Nutrition, 7th ed., ILSI Press, Washington D.C: 1996; S. 185–190.
- ↑ C. S. Fu, M. E. Swendseid, R. A. Jacob, R. W. McKee: „Biochemical markers for assessment of niacin status in young men: levels of erythrocyte niacin coenzymes and plasma tryptophan“, in: J. Nutr., 1989, 119 (12), S. 1949–1955; PMID 2621487; PDF.
- ↑ Michael Weber: Co-Enzym Q10: Die Erfolgsgeschichte eines Vitalstoffes. 2009, ISBN 978-3837023855 (Seite 48 in der Google Buchsuche).
- ↑ Futterzusätze bei Milchkühen
- ↑ Pressemitteilung von MSD für Fachkreise vom 29. Juni 2011.
- ↑ L. Jones Hollis: Abbott down after NIH halts Niaspan study. In: fiercepharma.com vom 26. Mai 2011.
- ↑ NIH stops clinical trial on combination cholesterol treatment. In: fiercepharma.com vom 26. Mai 2011.
Weblinks
- Swiss Forum For Sport Nutrition: Infoblatt Niacin (PDF
| Bitte den Hinweis zu Gesundheitsthemen beachten! |