Bisphosphonate
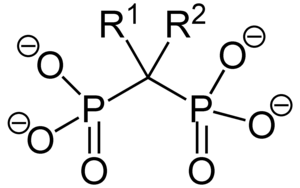
Bisphosphonate (auch Diphosphonate) sind chemische Verbindungen, die über zwei Phosphonat-Gruppen verfügen.
Verwendung
Bisphosphonate gehören einer Medikamentengruppe an, die seit den 1980er-Jahren für diagnostische und therapeutische Zwecke bei Knochen- und Calciumstoffwechselkrankheiten entwickelt wurde. Einige Verbindungen dieses Typs werden in Medikamenten zur Behandlung der Osteoporose verwendet. Sie sind in Deutschland zur Therapie der Osteoporose bei postmenopausalen Frauen, des Osteodystrophia deformans und der Tumor-assoziierten Hyperkalzämie zugelassen. Darüber hinaus finden sie Einsatz bei der Behandlung von Knochenmetastasen und Fibröser Dysplasie.[1]
In einer Studie aus dem Jahr 2009 wurde außerdem durch Hinzufügen von Zoledronat (eine Substanz aus der Gruppe der Bisphosphonate) zur endokrinen Therapie bei hormonsensiblem Brustkrebs eine längere rezidivfreie Überlebenszeit erzielt.[2]
Bisphosphonate dienen auch in Verbindung mit 99mTechnetium als Tracer in dem nuklearmedizinischen Untersuchungsverfahren Skelettszintigrafie. Dabei werden sie in einer sehr niedrigen, pharmakologisch nicht wirksamen Dosis angewendet.
Das Bisphosphonat Lexidronam wird in Verbindung mit dem überwiegenden Beta-Strahler 153Samarium zur palliativen analgetischen Therapie bei Knochenmetastasen eingesetzt (Radionuklidtherapie).
Wirkmechanismus
Bisphosphonate üben zwei Effekte auf den Knochen aus: Durch Anlagerung an die Knochenoberfläche hemmen sie einerseits die Mineralisation der Knochensubstanz, andererseits hemmen sie den Knochenabbau durch Hemmung der Osteoklasten. Bisphosphonate können Biomembranen nur sehr schwer überwinden, die Osteoklasten nehmen sie aber durch Phagocytose im Rahmen des Abbaus von Knochensubstanz auf. Nicht Stickstoff-haltige Wirkstoffe (z.B. Etidronat) scheinen dies über die Bildung von toxischen ATP-Analoga zu bewirken. Neuere Substanzen, die ein Stickstoff enthalten (z.B. Alendronat, Ibandronat), hemmen die Farnesylpyrophosphat-Synthase. Die Produkte dieses Enzyms, Farnesyl- und Geranylpyrophosphat, werden benötigt, um kleine G-Proteine (u.a. Ras) in der Zellmembran zu verankern. Fehlen diese G-Proteine, haben an Zellrezeptoren gebundene Wachstumsfaktoren keine Auswirkung auf die Zelle mehr. Infolgedessen sterben die Osteoklasten im Rahmen der Apoptose ab.[3]
Wirkstoffe
Bisphosphonate sind Diphosphat-Analoga, in denen der Sauerstoff der P–O–P-Bindung durch Kohlenstoff ersetzt ist. Verbindungen dieses Typs zählen zu den Phosphonaten. Sie unterliegen im Körper keiner enzymatischen Hydrolyse. Bevor man ihre therapeutische Wirkung bei Osteoporose entdeckte, wurden Bisphosphonate unter anderem als Waschmittelzusätze verwendet. Durch Modifikationen der Molekülstruktur wurden ihre therapeutischen Eigenschaften schrittweise verbessert. Zu den neueren Substanzen zählen die Aminobisphosphonate. In Deutschland sind folgende Bisphosphonate zugelassen: Alendronsäure, Clodronat, Etidronat, Ibandronat, Pamidronat, Risedronat, Tiludronat und Zoledronat. Zur Skelettszintigrafie wird unter anderem Oxidronat (HDP) verwendet.
- In der Medizin verwendete Bisphosphonate
Alendronsäure zur Behandlung der Osteoporose
Ibandronsäure zur Behandlung von Knochenmetastasen bei Brustkrebs und von Osteoporose
Pharmakokinetik
Bisphosphonate werden im Darm schlecht resorbiert und bilden mit Calcium unlösliche Komplexe. Die Resorptionsquote nach oraler Einnahme liegt zwischen 1 und 10 % der eingenommenen Dosis, teilweise ist sie noch geringer. Die Einnahmevorschriften müssen daher genau eingehalten werden. Bisphosphonate sollten morgens nüchtern mindestens 30 Minuten vor weiterer Nahrungsaufnahme oder anderen Medikamenten mit einem vollen Glas Leitungswasser eingenommen werden.
Etwa 20–50 % der resorbierten Menge wird im Knochen gespeichert. Der Rest wird innerhalb von 24 Stunden mit dem Urin oder Stuhl ausgeschieden. Die Halbwertszeit der Bisphosphonate im Skelett beträgt viele Jahre, ähnlich wie bei Tetrazyklinen oder Strontium.
Nebenwirkungen
Bei oraler Gabe treten bei zwei bis zehn Prozent der Patienten gastrointestinale Beschwerden wie Übelkeit, Bauchschmerzen, Erbrechen und Durchfall auf. Aufrechte Haltung während der Einnahme kann einen Rückfluss in die Speiseröhre (gastroösophagealer Reflux) und damit gastrointestinale Störungen vermeiden. Durch Komplexbildung mit Calciumionen im Darm können gelegentlich Hypokalzämien vorkommen. In Schwangerschaft und Stillzeit sind Bisphosphonate kontraindiziert.
In jüngster Zeit mehren sich Hinweise auf bisphosphonatassoziierte Knochennekrosen im Kieferbereich (BONJ, bisphosphonate-associated osteonecrosis of the jaw oder BRONJ, bisphosphonate-related osteonecrosis of the jaw), die klinisch sehr den Symptomen einer Osteoradionekrose ähneln und sehr therapieresistent sind. Ein relevantes Risiko für eine BP-assoziierte ONJ besteht, wenn aufgrund einer malignen Grunderkrankung Bisphosphonate intravenös in hohen Dosen und über einen längeren Zeitraum verabreicht werden. Das CHMP der EMA hat mit einer Mitteilung vom 24. September 2009 diese unerwünschten Wirkungen aus den Daten des Eudravigilance-Vorhabens bestätigt und weitere Ursachenforschungen gefordert.[4] Aber auch bei alleiniger oraler Medikation sind mittlerweile Fälle von Kieferknochennekrosen bekannt, meist im Zusammenhang mit einer vorhergehenden Zahnextraktion. Die Bisphosphonate inhibieren endotheliale Zellen und stören damit die intraossäre Angiogenese des Knochens. Der geschädigte Knochen ist somit in seiner Fähigkeit, auf Infekte oder Traumata zu reagieren, eingeschränkt.
Bisphosphonat-assoziierte Kiefernekrosen wurden nach einer Latenzzeit von gut zehn Jahren nach Zulassung der ersten Bisphosphonate in den späten 1980er-Jahren als Syndrom beschrieben.[5] Diese Kiefernekrosen ähnelten den Kiefernekrosen nach Vergiftungen durch weißen Phosphor, wie sie im 19. Jahrhundert aus der Streichholz-Industrie bekannt waren. Die klinische Diagnose der Bisphosphonat-assoziierte Kiefernekrose ist nur schwer zu stellen. Definitionsgemäß ergibt sie sich aus der Anamnese mit einer Vorbehandlung mit oralen oder intravenös verabreichten Bisphosphonaten. In einigen Studien hat der Gesichtsschädel eine bis zu 20fach höhere knöcherne Umbauaktivität als das übrige Skelett, was die verstärkte Bisphosphonateinlagerung im Kieferknochen erklären könnte.[6]
In der Skelettszintigrafie verwendete Bisphosphonate haben aufgrund der extrem niedrigen Dosierung keine Nebenwirkungen. Lediglich bei fehlerhafter Injektion in das Gewebe neben der Vene kommt es zu einem sehr kurz anhaltenden brennenden Gefühl. Die Einschränkungen der Indikation nuklearmedizinischer Untersuchungen in Schwangerschaft und Stillzeit sowie die Strahlenexposition durch das Radionuklid sind zu beachten.
Laut der HORIZON-Studie trat bei Behandlung mit dem Bisphosphonat Zoledronsäure bei nicht wenigen Patientinnen (1,3 Prozent) auch schweres Vorhofflimmern auf, das bisher bei Bisphosphonaten nicht beobachtet worden war. Das Vorhofflimmern lag unter der für diese Altersgruppe zu erwartenden Rate und wurde in anderen Studien mit Zoledronsäure nicht beobachtet.[7]
Jüngere Studien zur Langzeitanwendung der Alendronsäure führten zu einem Hinweis im WHO Pharmaceuticals Newsletter in der Rubrik Safety of Medicines auf die Veröffentlichung des MHRA bezüglich möglicher atypischer Frakturen des Femurschafts (Corpus ossis femoris).[8] Atypische Frakturen des Femurs treten meist am proximalen Schaft auf und zeigen typische radiologische Merkmale. Sie können durch ein minimales Trauma ausgelöst werden, kommen jedoch auch ohne Trauma vor. Die Frakturen sind häufig bilateral und weisen eine schlechte Heilungstendenz auf.[9] Der Verdacht, dass Bisphosphonate langfristig den Knochenumbau stören und das Risiko für Frakturen deutlich erhöhen, wird durch eine neuere Studie erhärtet. Nach fünf Jahren Behandlung sei jedoch das Verhältnis von Nutzen zu Risiko immer noch günstig.[10] Aufgrund von epidemiologischen Hinweisen hat das CHMP (Committee for Medicinal Products for Human Use) bei der Europäischen Arzneimittelagentur (European Medicines Agency, EMA) einen möglichen Zusammenhang von atypischen Femurfrakturen mit der Gabe von Bisphosphonaten auf Basis der vorhandenen Daten umfassend bewertet.[11]
Weitere mögliche Nebenwirkungen von Bisphosphonaten sind Verwirrtheit sowie optische, akustische und olfaktorische Halluzinationen.
Quellen
- ↑ R. Chapurlat: Current pharmacological treatment for fibrous dysplasia and perspectives for the future. In: Joint Bone Spine. Band 72, Nummer 3, 2005, S. 196–198. doi:10.1016/j.jbspin.2004.08.001
- ↑ M. Gnant, B. Mlineritsch, W. Schippinger u. a.: Endocrine therapy plus zoledronic acid in premenopausal breast cancer. In: N Engl J Med. Band 360, Nummer 7, Februar 2009, S. 679–691, PMID 19213681
- ↑ Heinz Lüllmann, Klaus Mohr, Lutz Hein : Pharmakologie und Toxikologie, Stuttgart, 2006 S. 262-264
- ↑ EMA: Bisphosphonates and osteonecrosis of the jaw. Vom 24. September 2009
- ↑ Journal of Oral and Maxillofacial Surgery (2003 61:1115-7) Brief von E. Marx aus Maiami an den Herausgeber
- ↑ Stefan Lachmann, Siegmar Reinert, Sebastian Hoefert: Thema mit großer Praxisrelevanz. Tübinger Bisphosphonat-Symposium. ZM 102, Nr. 6A, 16. März 2012, (S. 716-720)
- ↑ Ergebnis der randomisierten HORIZON-Studie: Once-Yearly Zoledronic Acid for Treatment of Postmenopausal Osteoporosis. In: New England Journal of Medicine 356, 2007, S. 1809-1822. Hier zitiert nach: Deutsches Ärzteblatt, 3. Mai 2007 (online)
- ↑ MHRA: Drug Safety Update. Band 2, Nummer 8, vom 8. März 2009.
- ↑ Shane E, Burr D, Ebeling PR et al.: Atypical subtrochanteric and diaphyseal femoral fractures: report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res 2010; 25: 2267-2294.
- ↑ JAMA, February 23, 2011—Vol 305, No. 8: Bisphosphonate Use and the Risk of Subtrochanteric or Femoral Shaft Fractures in Older Women
- ↑ CHMP: European Medicines Agency concludes class review of bisphosphonates and atypical fractures WebSite der Europäischen Arzneimittelagentur (European Medicines Agency, EMA), 15 April 2011
| Bitte den Hinweis zu Gesundheitsthemen beachten! |