Berliner Blau
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 4 Fe3+ · 3 | |||||||||
| Allgemeines | |||||||||
| Name | Eisen(III)-hexacyanoferrat(II/III) | ||||||||
| Andere Namen |
| ||||||||
| Summenformel | Fe7C18N18 | ||||||||
| CAS-Nummer | 14038-43-8 | ||||||||
| ATC-Code | |||||||||
| Kurzbeschreibung |
blauer, geruchloser Feststoff[1] | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 859,23 g·mol−1 | ||||||||
| Aggregatzustand |
fest | ||||||||
| Dichte | |||||||||
| Schmelzpunkt | |||||||||
| Löslichkeit |
schwer in Wasser[1] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| LD50 | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Berliner Blau ist ein lichtechtes, tiefblaues, anorganisches Pigment. Als altes Pigment ist das C.I. Pigment Blue 27 (77510) auch unter den Namen Pariser Blau, Französischblau, Eisencyanblau, Turnbulls Blau, Bronzeblau, Preußisch Blau, Pottascheblau, Chinesischblau, Miloriblau, Stahlblau, Tintenblau, Tonerblau bekannt, wobei sich diese Varianten durch Anwendung, Herstellung und Farbstich unterscheiden können[3].
Berliner Blau wird aus einer Lösung von Eisen(III)-Salz und gelbem Blutlaugensalz hergestellt und findet Verwendung als Anstrichmittel und zum Tapetendruck sowie als Gegenmittel bei Vergiftungen mit radioaktivem Cäsium oder Thallium.
Grundlagen
Berliner Blau gilt als das erste moderne Pigment, das in dieser Form nicht in der Natur vorkommt. In der Farbenindustrie wird Berliner Blau auch Eisenblau genannt. Dieser Name bezeichnet auch ein altertümliches Pigment aus dem Mineral Vivianit.
Vom Farbton wird es auch als Preußischblau, Stahlblau, in einer Variante als Miloriblau bezeichnet.
Versetzt man eine Lösung von gelbem Blutlaugensalz mit einem in Wasser gelösten Eisen(III)-Salz oder eine Lösung von rotem Blutlaugensalz mit einem in Wasser gelösten Eisen(II)-Salz, so entsteht in beiden Fällen bei einem Molverhältnis von 1:1 das gleiche kolloid gelöste „lösliche Berliner Blau“ („lösliches Turnbulls Blau“):
- $ \mathrm {Fe^{3+}+K_{4}[Fe^{II}(CN)_{6}]\longrightarrow 3\ K^{+}+K[Fe^{III}Fe^{II}(CN)_{6}]} $
- $ \mathrm {Fe^{2+}+K_{3}[Fe^{III}(CN)_{6}]\longrightarrow 2\ K^{+}+K[Fe^{III}Fe^{II}(CN)_{6}]} $
Erst bei Zugabe überschüssiger Eisen(III)- bzw. Eisen(II)-Ionen bildet sich ein blauer Niederschlag, der als „unlösliches Berliner Blau“ (auch „unlösliches Turnbulls Blau“)
- $ \mathrm {Fe^{III}[Fe^{III}Fe^{II}(CN)_{6}]_{3}\ \cdot \ 14-16\,H_{2}O} $
bezeichnet wird und als Farbpigment verwendet werden kann (Gewinnung und Darstellung).
Farblehre
(Farbcode: #232c3f)
- Die Farbe des Pigments liegt nicht im Gamut möglicher Monitorleuchtstoffe und ist auf dem angeschlossenen Monitor aufgrund der hohen Farbsättigung des Farbmittels nicht darstellbar. Ein ihm nahe kommender Farbton hat etwa den Wert RGB = {35, 44, 63} dezimal beziehungsweise 232C3F hexadezimal[4].
- Der Farbreiz der Körperfarbe kommt einer Spektralfarbe von ungefähr 475 nm nahe.
- Es ist als RAL 5011 Stahlblau im RAL-Farbsystem verzeichnet.
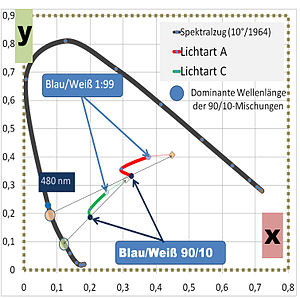
Die Tristimuluswerte werden durch eine Weißabmischung beeinflusst. Auch die Lichtart, unter der die Proben beobachtet werden, verändern den Farbeindruck bei gleichem Farbreiz, insbesondere wirkt sich dabei der Rotstich des Pigmentes aus.
| Farbkoordinate | Lichtart A | Lichtart C | ||||
|---|---|---|---|---|---|---|
| Berliner Blau/ Titanweiß | 90/10 | 10/90 | 1/90 | 90/10 | 10/90 | 1/90 |
| Tristimuluswerte | ||||||
| X | 0,96 | 12,90 | 43,36 | 1,29 | 17,58 | 54,54 |
| Y | 0,95 | 15,69 | 45,94 | 1,14 | 18,80 | 49,52 |
| Z | 1,04 | 15,26 | 25,72 | 3,71 | 51,95 | 86,31 |
| Farbart nach CIE | ||||||
| x | 0,3250 | 0,2947 | 0,3770 | 0,2101 | 0,1990 | 0,2505 |
| y | 0,3220 | 0,3578 | 0,3994 | 0,1857 | 0,2128 | 0,2746 |
| Dominante Wellenlänge (nm) | 481,5 | 489,0 | 492,0 | 472,0 | 478,6 | 482,0 |
Geschichte
Wahrscheinlich um 1706 wurde Berliner Blau erstmals von dem Berliner Farbenhersteller Diesbach hergestellt.[5][6] Berger gibt als einzige historische Quelle einen Vornamen für Diesbach an, nämlich Johann Jacob.[7] Die früheste bekannte schriftliche Nennung des Pigments erfolgt in einem Brief vom 31. März 1708, den Johann Leonhard Frisch an den Präsidenten der Preußischen Akademie der Wissenschaften Gottfried Wilhelm Leibniz geschrieben hat.[8] Frisch war verantwortlich für die frühe Vermarktung des Pigments. Er behauptete von sich, das Pigment durch eine Säurebehandlung verbessert zu haben. Frisch ist auch der Verfasser der ersten Publikation zum Berliner Blau in Notitia Coerulei Berolinensis nuper inventi von 1710. Diesbach stand etwa ab 1701 in Frischs Diensten.
Neben Diesbach wird von Georg Ernst Stahl auch Johann Konrad Dippel mit der Erfindung in Verbindung gebracht. Wie verlässlich diese Angabe und die damit verbundene Geschichte der ersten zufälligen Herstellung des Pigments ist, kann heute schlecht beurteilt werden. Demnach war Diesbach mit der Herstellung eines roten Farbstoffs beschäftigt, als ihm die Pottasche (Kaliumcarbonat) zur Ausfällung des Farbstoffs ausging. Von seinem Kollegen Johann Konrad Dippel ließ er sich deshalb einen Ersatzstoff geben (verunreinigt mit „Dippels Tieröl“), der jedoch entgegen seinen Erwartungen einen blauen Farbstoff ausfällte.[9] Das Rezept konnte einige Zeit geheim gehalten werden, bis es schließlich der Engländer John Woodward 1724 in den Philosophical Transactions veröffentlichte.
Das 1709 durch Pieter van der Werff in Rotterdam geschaffene Gemälde "Die Grablegung Christi" (Bildergalerie Sanssouci, Potsdam) stellt den frühesten bisher bekannten Nachweis der Verwendung des Pigments in der Malerei dar. Um 1710 wird es von Malern am Preußischen Hof vielfach genutzt und erreicht auch Paris, wo es durch Antoine Watteau und später von seinen Nachfolgern Nicolas Lancret und Jean-Baptiste Pater verwendet wird.[5]
In Theodor Fontanes Roman Frau Jenny Treibel ist die Berliner Familie Treibel im Besitz großer Fabriken zur Produktion von Berliner Blau. Vorbild dieser Literaturgestalt ist die Unternehmerfamilie Kunheim (Chemische Fabriken Kunheim u. Co. AG und ab 1925 Rhenania- Kunheim Verein Chemischer Fabriken AG)[10], mit der Fontanes Schwester Jenny Sommerfeld befreundet war.
Eigenschaften
Das Pigment hat hervorragende Echtheiten. Neben seiner Brillanz besitzt es ein hervorragendes Deckvermögen und eine hohe Farbstärke. Die Lichtechtheit ist gut, allerdings nicht bei gering pigmentierten Pastelltönen. Es blutet weder in Wasser, Ethanol oder Methylethylketon noch in unpolaren Mineralölen, Di-n-octylphthalat oder Leinölfirnis. Allerdings besitzt es nur eine geringe Alkalienbeständigkeit und ist auch gegen Säuren nur mäßig beständig. Die Wetterbeständigkeit ist stark von der Rezeptierung bestimmt. Das Pigment lässt sich ausreichend dispergieren und besitzt eine gute Hitzeechtheit. Abhängig von der Anwendung beträgt der Ölbedarf des Pigments zwischen 70 und 120 kg Öl für 100 kg Pigment.[3]
Da alle diese Blaupigmente aus den gleichen Rohmaterialien hergestellt werden, sind die Prozess- und Herstellungsbedingungen entscheidend für die Eigenschaften und den vorgesehenen Verwendungszweck.
Gegenüber schwachen Säuren ist Berliner Blau stabil. Der Cyanoferratkomplex wird wegen des geringen Löslichkeitsproduktes nicht zerstört und CN−-Ionen werden nicht freigesetzt, so dass keine freie Blausäure entsteht.
Durch Laugen wird der Komplex angegriffen, es bildet sich braunes Eisen(III)oxid-hydroxid. Deshalb wird dieses Blaupigment nicht für Freskenmalereien eingesetzt.
Namensgebung und Synonyme
Im August 1709 benennt Johann Leonhard Frisch das Pigment als „Preussisch blau“, im November desselben Jahres ändert er die Bezeichnung in „Berlinisch Blau“.[8]
- französisch: Bleu de prusse, Bleu de Milori
- englisch: iron blue, toning blue.
- Im Colour Index wird Berliner Blau als C.I. Pigment Blue 27 nach der Farbe und als 77510 nach der Struktur geführt.
Aus der Struktur des Pigments leiten sich die Namen Eisencyanblau, Eisencyanürcyanid, Ferrozyanblau und auch Ferriferrocyanidblau sowie Stahlblau ab.
Durch unterschiedliche Hersteller, deren Firmensitz oder abweichende Stoffeigenschaften wegen unterschiedlicher Herstellungsverfahren sind oder waren weitere Namen für das Pigment gebräuchlich.
- Antwerpener Blau,
- Bronzeblau, der leicht bronzierende rote Farbstich zeigt sich bei verschiedenen Bindemitteln, insbesondere bezieht sich Bronzeblau auf den rötlichen Glanz der ungemahlenen, schwarzblauen Brocken.[11]
- Chinesisch Blau (Chinablau): Diese Produktionsvariante des Pigmentes ergibt die reinsten und brillantesten Farbtöne mit einem Grünstich. Es ergibt den besten Vollton und die höchste Deckkraft, allerdings hat es auch die härteste Struktur und den höchsten Ölbedarf.
- Delfter Blau,
- Diesbachblau ist nach dem eigentlichen Erfinder benannt.
- Eisenblau ist der Name des farbtragenden Eisenanteils im Pigment.
- Vivianit,
- Pariser Blau, Paris war der Herstellungsort für Miloriblau.
- Miloriblau: Die Firma A. Milori Co. of France hatte nach Diesbach ein Blaupigment auf einem anderen Verfahrensweg gewonnen, das im Vergleich zum Preußischblau etwas schwächer in seiner Farbstärke ist. Der Name Miloriblau hat sich bis heute erhalten.
- Pottascheblau: Bis zum Ersten Weltkrieg war das Kation des Komplexsalzes vorwiegend Kalium. Als zu Beginn des 20. Jahrhunderts der Preis von Pottasche stark anstieg, wurde auch das Ammoniumsalz mit gleich guten Eigenschaften hergestellt.
- Sächsischblau: Uniformen der sächsischen Armee wurden ebenfalls mit Berliner Blau gefärbt.
- Turnbulls Blau
- Vossenblau wurde nach der L. Vossen & Co G.m.b.H. bei Düsseldorf benannt, die ab 1905 exklusiv den Vertrieb durchführte.
- Zwickauer Blau: Der Produktionsort ergab diesen Produktnamen.
Luisenblau, Modeblau, Wasserblau sind Produktnamen für die Textilfärberei und mögen als Modefarben entstanden sein.
Das rotstichigste Pigment ist Miloriblau, die grünstichigste Variante ist das sogenannte Chinesisch Blau.
Verwendung
Berliner Blau wird aufgrund seines feinen Korns und der daraus resultierenden Lasierfähigkeit sowie seiner großen Farbstärke bis heute für Aquarell-, Öl- und Druckfarben verwendet. In der Wandmalerei indes ist es unbrauchbar, da es rasch verbraunt.
Die größten Mengen von Berliner Blau werden für chemische Beschichtungen, für Druckfarben (als ISO-Blau), Kohlepapier und in der Kunststoffindustrie eingesetzt. Eine geringere Menge wird bei der Papierherstellung verbraucht. In seinem Vollton ergibt dieses Pigment einen sehr dunklen, fast schwarzen Farbton; in dieser Form besitzt es eine Bedeutung für transparente Finishs auf Metallfolien, auch für Blechdruckfarben. Besonders geeignet ist die Eigenschaft im Zusammenhang mit Aluminiumpulver für glänzende Oberflächenbehandlungen.
In der Medizin wird Berliner Blau bei einigen Vergiftungen – insbesondere bei Verbindungen mit Caesium und Thallium – als Mittel zur Bindung des Giftes verwendet, welches dann zusammen mit dem Farbstoff ausgeschieden wird. Es wurde beispielsweise nach der Katastrophe von Tschernobyl eingesetzt, um Tiere zu dekontaminieren, die radioaktives 137Cs aufgenommen hatten (Radiogardase-Cs).[12]
Die Reaktion zum Berliner Blau ist eine sehr empfindliche Methode für den Eisennachweis. In der analytischen Chemie ist deshalb die Berliner-Blau-Reaktion als Nachweis von Eisen (oder von Cyaniden) eine verbreitete Methode. Auf Grund der hohen Empfindlichkeit wegen der hohen Farbstärke ist diese auch in der Mikrochemie und als Tüpfelprobe geeignet.
- Berliner Blau wird als echtes Farbmittel zu Füllhaltertinten benutzt.
- In der Pathologie wird Berliner Blau als Reaktion auf Eisen genutzt, um Herzfehlerzellen oder eine Siderose zu diagnostizieren.
- Bei der Papierherstellung werden wasserdispergierbare Typen allgemein eingesetzt, die als lösliches Eisenblau bezeichnet werden.
- Für die Kunststoffeinfärbung hat sich Berliner Blau sehr bei der Färbung von ND- und HD-Polyethylen bewährt.
- Eine häufige Anwendung findet Miloriblau in Kombination mit Chromgelb (C.I. Pigment Yellow 34) zum sogenannten Chromgrün. Durch die Farbstärke und Deckkraft des Berliner Blaus erhält man ein sehr gutes Grünpigment.
Gewinnung und Darstellung
Vormals
- Methode nach Diesbach
- Cochenille-Läuse werden in Alaun und Eisensulfat gekocht. Anschließend wird der Farbstoff mit „Dippels Tieröl“ ausgefällt.
- Englisches Rezept
- Gleiche Teile von Kaliumnitrat (Salpeter) und Kaliumtartrat (Backtriebmittel) werden in einem Schmelztiegel erhitzt. Nach Zugabe von getrocknetem Tierblut wird die Mischung weiter erhitzt. Die entstandene Masse wird mit Wasser gewaschen und mit Alaun und Eisensulfat vermischt. Eine Endbehandlung mit Salzsäure verändert die zunächst grünliche Farbe in tiefes Blau.
Turnbulls Blau
Turnbulls Blau ist ein historisch entstandenes Synonym für das Berliner Blau.
Die Gewinnung erfolgt durch das Umsetzen von Eisen(II)-salzen mit Kaliumhexacyanoferrat(III) (rotes Blutlaugensalz) in wässriger Lösung. Man nahm an, dass der sich bildende dunkelblaue Niederschlag eine andere Zusammensetzung als das durch Umsetzen von Eisen(III)-salzen mit Kaliumhexacyanoferrat(II) (gelbes Blutlaugensalz) gewonnene Berliner Blau aufwies. Mittels EPR- und Mößbauerspektroskopie konnte jedoch festgestellt werden, dass die Reaktionsprodukte weitgehend identisch sind, da folgendes Gleichgewicht besteht:
- $ \mathrm {Fe^{2+}+[Fe(CN)_{6}]^{3-}\ \rightleftharpoons \ Fe^{3+}+[Fe(CN)_{6}]^{4-}} $ [13]
Miloriblau
Miloriblau bezeichnet gekochte Sorten des Pigments, die einen etwas wärmeren rotstichigen Farbton aufweisen und erstmals von der Firma Milori de France hergestellt wurden.
Industrielle Produktion
Die direkte Reaktion wird in der Pigmentproduktion seltener benutzt. Dieser Reaktionsweg wird meist für die Herstellung von Präparaten genutzt. Eisen- und Hexacyanoferrat-Ionen werden in Wasser vermischt.
- $ \mathrm {FeCl_{3}+K_{4}[Fe(CN)_{6}]+H_{2}O\ oder\ FeCl_{2}+K_{3}[Fe(CN)_{6}]+H_{2}O} \ \xrightarrow {\ } {\mbox{Berliner Blau}} $
Zunächst fällt kolloidales Berliner Blau aus, mit einem Überschuss von Eisenionen bildet sich dann Berliner Blau.
Die Industrielle Produktion nutzt den indirekten Weg über den Umsatz zum sogenannten Berliner Weiß.
Häufiger werden statt der kaliumhaltigen Rohstoffe die Ammoniumsalze genutzt.
- $ \mathrm {FeSO_{4}\cdot 7\,H_{2}O+Na_{4}Fe(CN)_{6}\cdot 10\,H_{2}O+(NH_{4})_{2}SO_{4}\ \xrightarrow {\ } Fe(NH_{4})_{2}Fe(CN)_{6}+2\,Na_{2}SO_{4}+17\,H_{2}O} $
Das erhaltene Berliner Weiß wird nun mit Schwefelsäure bei 75–100 °C ausgezogen und mit Natriumbichromat oder Natriumchlorat oxidiert.
- $ \mathrm {6\,Fe(NH_{4})_{2}Fe(CN)_{6}+3\,H_{2}SO_{4}+NaClO_{3}\ \xrightarrow {\ } 6\,Fe(NH_{4})Fe(CN)_{6}+NaCl+3\,H_{2}O+3(NH_{4})_{2}SO_{4}} $
Das Produkt wird gewaschen und gefiltert oder abgepresst, dann bei 15–30 °C getrocknet. Anschließend wird das Pigment auf die erforderliche Korngröße ausgerieben und verpackt. Das fertige Produkt enthält noch 4–7 % absorbiertes und hydratisiertes Wasser.
Wenn das Herstellungsergebnis sehr fein gemahlen wird, erhält man das gut in Wasser dispergierbare und beständige „lösliche“ Berliner Blau. Durch unterschiedliche Nachbehandlungen erhält man eine breite Produktpalette für die angestrebten Einsatzzwecke. Eine weitere Behandlung mit anionischen, nichtionischen oder kationischen Tensiden kann zu einer drastischen Änderung von Ölbedarf, Struktur und Glanz führen.
Für das Pigment Berliner Blau werden bei der Bildung noch weitere Substanzen, wie Kaliumchlorid zugesetzt. Diese Substanzen beeinflussen die Fällung physikalisch und bilden im Filterkuchen lösliche Salze. Dadurch bilden sich keine kompakten Agglomerate. Für die Anwendung als Farbpigment sollte das anorganische Produkt „weich“ sein, mit diesem Fachbegriff ist feinkörnig gemeint. Ein „weiches“ Pigment lässt sich im Bindemittel leichter dispergieren.
Sicherheitshinweise und Unglücksfälle
Die Resorbierbarkeit von Berliner Blau unter physiologischen Bedingungen ist außerordentlich gering, da es praktisch unlöslich in Wasser und verdünnten Säuren ist. Es ist davon auszugehen, dass weder über die Haut, noch über Atemwege oder Verdauungstrakt größere Mengen aufgenommen werden. Daher kann es mit hoher Wahrscheinlichkeit als praktisch untoxisch eingestuft werden. Der Stoff ist unter der Wassergefährdungsklasse 1 eingestuft, in Worten heißt diese Klasse schwach wassergefährdend.
Wird es stark über 140 °C erwärmt, könnten allerdings Blausäuredämpfe und Ammoniak als Zersetzungsprodukte entstehen.
Ein unsachgemässer Umgang mit Berliner Blau war vermutlich die Ursache des Brandes von Schweizerhalle.
Bildung von Berliner Blau in Gaskammern des Vernichtungslagers Auschwitz
Erstmalig wurde die Frage nach einer möglichen Eisenblau-Bildung durch Zyklon B bzw. durch die darin enthaltene Blausäure im Prozess gegen den Holocaustleugner Ernst Zündel aufgebracht. Von Zündel wurde Fred A. Leuchter als Gerichtsgutachter bestellt. Dieser hatte den Leuchter-Report verfasst, in dem behauptet wird, da kein Eisenblau in den Gaskammern des KZ Auschwitz-Birkenau gefunden wurde, könnten keine Menschen mittels Zyklon B vergast worden sein. Aufgegriffen wurde diese Behauptung von Germar Rudolf, der als Gutachter im Prozess gegen den Holocaustleugner Otto Ernst Remer das Rudolf-Gutachten verfasst hat. Offensichtliche methodische Fehler im Leuchter-Report wie beispielsweise die nicht beachtete unterschiedliche Toxizität für Menschen und Insekten wurden im Rudolf-Gutachten behandelt.
Im Prozess David Irving gegen Deborah Lipstadt wurde der Chemiker Richard Green als Gerichtsgutachter bestellt und hat sich detailliert mit dem Rudolf-Gutachten auseinandergesetzt. Dabei stellte Green fest, dass wesentliche Einflüsse auf die Bildung von Eisenblau von Rudolf nicht beachtet wurden. Unter anderem wurde von Green dargelegt, dass das von den Opfern ausgeatmete Kohlenstoffdioxid verhindert, dass das Blausäuregas überhaupt Eisenblau in den Gaskammern bilden kann. Hier sei auch ein augenfälliger Unterschied zu den Entwesungskammern zu sehen, bei denen keine erhöhte Kohlendioxidkonzentration in der Luft vorhanden war.[14] Zudem wurde eine detaillierte Studie des Forensischen Institutes in Krakau zu diesem Themenkomplex erstellt. In dieser Studie waren mittels einer präzise kalibrierten Methode lösliche Cyanide sowohl in den Entwesungskammern als auch in den Gaskammern nachweisbar. Vergleichsproben aus nicht begasten Gebäuden im KZ Auschwitz-Birkenau enthielten diese Cyanide nicht.[15]
Literatur
- Alexander Kraft: Alchemie in Berlin: Erfindung und Verbreitung des Berliner Blau in: Mitteilungen des Vereins für die Geschichte Berlins, Heft 3/2009
- Hans-Peter Schramm, Bernd Hering: Historische Malmaterialien und ihre Identifizierung. o.V. Stuttgart, 1995. Reprint Ravensburg, 2000. ISBN 3-473-48067-3
- Kurt Wehlte: Werkstoffe und Techniken der Malerei. Otto Maier Verlag. Ravensburg, 1967. ISBN 3-473-48359-1 (früher: ISBN 3-473-61157-3)
Weblinks
- Thomas Seilnacht: Preußisch Blau.
- MATERIAL ARCHIV: Berliner Blau – Umfangreiche Materialinformationen und Bilder
- Jens Bartoll: The Early Use of Prussian Blue in Paintings (zur ersten Herstellung, Vermarktung und Verwendung - englisch)
- Volkert Emrath: Einige alte Pigmente und Farbstoffe, deren Herkunft u. Verwendungszeiten in der Tafel-, Buch- und Miniaturmalerei vor ca. 1780. (XGA)
- G. H. C. Lippold: Berliner Blau, in: Magazin der Handels- und Gewerbskunde, 2. Jg. 1804, S. 443-446
- Military Miniatures Magazine: Pariser oder Preußisch Blau. Historische Farben für Zinnfiguren.
- Die "Revisionisten" und die Chemie von Josef Bailer (zum Thema Holocaustleugnung)
- The Chemistry of Auschwitz, Richard Green (englisch) (zum Thema Holocaustleugnung)
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 Eintrag zu Eisen(III)-hexacyanoferrat(II) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. September 2007 (JavaScript erforderlich)
- ↑ Berliner Blau bei ChemIDplus
- ↑ 3,0 3,1 3,2 Joseph A. Sisteno: Feriferrocyanide Pigments. In: Temple C. Button: Pigment Handbook. Volume I, I-C-d
- ↑ CIELab C*=40, h°≈270±10, nach Bruce MacEvoy: prussian blue PB27. In: Handprint. Color Vision. (8. Mai 2006)
- ↑ 5,0 5,1 J.Bartoll, B. Jackisch, M. Most, E. Wenders de Calisse, C. M. Vogtherr: Early Prussian Blue. Blue and green pigments in the paintings by Watteau, Lancret and Pater in the collection of Frederick II of Prussia. In: TECHNE 25, 2007, S. 39-46
- ↑ Bartoll: THE EARLY USE OF PRUSSIAN BLUE IN PAINTINGS
- ↑ J. E. Berger: Kerrn aller Fridrichs=Städtschen Begebenheiten Manuskript, Berlin, ca.1730 (Berlin, Staatsbibliothek zu Berlin – Preußischer Kulturbesitz, Handschriftenabteilung, Ms. Boruss. quart. 124)
- ↑ 8,0 8,1 J. L. Frisch: Briefwechsel mit Gottfried Wilhelm Leibniz L. H. Fischer (Herausgeber), Berlin, Stankiewicz Buchdruck, 1896, reprint Hildesheim/New York: Georg Olms Verlag, 1976
- ↑ Stahl, Georg Ernst: Experimenta, Observationes, Animadversiones, CCC Numero, Chymicae et Physicae, Berlin 1731, S. 281 ff.
- ↑ Hans Soost: Berliner Blau aus der Firma Kunheim (abgerufen 14. Februar 2010)
- ↑ Wehlte, S. 161ff
- ↑ ZEIT Online (vom 22. März 2011): Mit „Preußischblau“ als Arznei gegen radioaktives Cäsium
- ↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. (101. Auflage); Jander, Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. (13. Auflage); Ehlers: Analytik I. (8. Auflage)
- ↑ Richard Green: Leuchter, Rudolf & the Iron Blues, 31. Dezember 1998
- ↑ Polish Report on Cyanide compounds, Auschwitz-Birkenau, Nizkor Project, 1996