Asymmetrische Dihydroxylierung
Die Asymmetrische Dihydroxylierung ist eine von K.B. Sharpless entwickelte katalytische asymmetrische Oxidation eines Olefins zu einem cis-vicinalen Diol. Die hohe Enantioselektivität der Reaktion kommt durch den Einsatz eines chiralen Liganden zustande.
Reagenzien
Die Reaktion wird mit einer katalytischen Menge Osmium(VIII)-oxid durchgeführt, das meistens als ein Os(VI)-Salz zugegeben wird und im Reaktionsverlauf von einem Kooxidans - K3Fe(CN)6[1] oder auch NMO - zur Os(VIII)-Spezies oxidiert wird.
Als chirale Liganden werden oft Dihydrochinin- oder Dihydrochinidinderivate[2] zugesetzt, was im Handel als AD-Mix angeboten wird. AD-Mix α enthält neben K2OsO2(OH)4, K3Fe(CN)6 und K2CO3 den Liganden (DHQ)2PHAL in katalytischer Menge, während AD-Mix β als Liganden (DHQD)2PHAL enthält. Beide Liganden sind diastereomorph. Als Lösungsmittel wird ein Zwei-Phasen-Gemisch - beispielsweise tert-Butanol und Wasser - verwendet, um eine vorzeitige Reoxidation des cyclischen Osmats und den damit einhergehenden Verlust der Enantioselektivität zu verhindern. Zudem wird oft Methansulfonamid eingesetzt, das die Hydrolyse beschleunigt und als Phasentransferkatalysator fungiert[3].
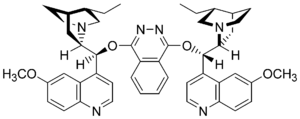
Das Osmium(VIII)oxid wird über ein freies Elektronenpaar im sp3-Atomorbital des Stickstoffs eines Dihydrochinidins (siehe Grafik) gebunden, was eine Ligandenbeschleunigung zur Folge hat und die gesamte Reaktion über den Reaktionspfad des chiralen Komplexes ablaufen lässt. Dies wiederum hat die hohe Enantioselektivität zur Folge. Aufgrund der durch die Konformation des Liganden und des daran gebundenen Osmium(VIII)-oxids wird eine "chirale Tasche" gebildet, ähnlich dem aktiven Zentrum eines Enzyms, in der sich das Olefin nur in einer bestimmten Konformation orientiert[4][5].
Reaktionsmechanismus
Aus dem Olefin und dem Osmium(VIII)-oxid-Ligand-Komplex geht durch eine [3+2] Cycloaddition ein fünfgliedriges cyclisches Intermediat hervor, das hydrolysiert und das Diol freisetzt. Zudem entsteht das reduzierte Osmat, welches von dem überstöchiometrisch zugesetzten Kooxidans reoxidiert wird.
Einzelnachweise
- ↑ Minato. M.; Yamamoto K.; Tsuji J.; J. Org. Chem. 1990, 55 (2), 766–768. (doi:10.1021/jo00289a066)
- ↑ P. Duoau, R. Epple, A.A. Thomas, V.V. Fokin, K.B. Sharpless: Advanced Synthesis & Catalysis. Weinheim 344.2002, 421. ISSN 1615-4150
- ↑ Junttila M. H.; Hormi O.O.E.; J. Org. Chem. 2009, 74 (8), 3028-3047. (doi:10.1021/jo8026998)
- ↑ Corey E.J.; Noe M.C.; Sarshar S.; Tetrahedron Letters 1994, 35 (18), 2861-2864. (doi:10.1016/S0040-4039(00)76644-5)
- ↑ Kolb H.C.; Andersson P.G.; Sharpless K.B.; J. Am. Chem. Soc. 1994, 116 (4), 1278-1291. (doi:10.1021/ja00083a014)
Literatur
- Kolb, H. C.; Van Nieuwenhze, M. S.; Sharpless, K. B.; Chemical Reviews 1994, 94, 2483-2547. (doi:10.1021/cr00032a009)
- R. Brückner: Reaktionsmechanismen. 2. Aufl. Spektrum, Heidelberg/Berlin 2003, S. 753–758. ISBN 3-8274-1189-0
- J.J. Li: Name reactions for functional group transformations. Wiley Interscience 2007, S. 67-83. ISBN 978-0-471-74868-7