Calcit
| Calcit | |
| Calcitzwilling | |
| Andere Namen |
|
| Chemische Formel |
Ca[CO3] |
| Mineralklasse | wasserfreie Carbonate ohne fremde Anionen 5.AB.05 (8. Auflage: V/B.02) nach Strunz 14.01.01.01 nach Dana |
| Kristallsystem | trigonal |
| Kristallklasse; Symbol nach Hermann-Mauguin | ditrigonal-skalenoedrisch 3 2/m |
| Farbe | meist farblos, milchig weiß, grau, gelb, rosa, rot, blau, grün, braun bis schwarz |
| Strichfarbe | weiß |
| Mohshärte | 3 |
| Dichte (g/cm3) | 2,6 bis 2,8 ; rein 2,715 |
| Glanz | Glasglanz, auch Perlmuttglanz |
| Transparenz | durchsichtig bis undurchsichtig |
| Bruch | muschelig, spröde |
| Spaltbarkeit | sehr vollkommen nach (1011)
Spaltwinkel 75° |
| Habitus | sehr unterschiedlich, Konkretionen, oolithisch, stalaktitisch, körnig, massig |
| Häufige Kristallflächen | {1010}, {0001}, {0112}, {0221} |
| Zwillingsbildung | (0001), sehr häufig Gleitzwillinge (polynynthetische Translationslamellen) nach (0112) |
| Kristalloptik | |
| Brechungsindex | bei ~590 nm: nω=1,640 bis 1,660 rein 1,658
nε=1,486 |
| Doppelbrechung (optischer Charakter) |
Δ=0,154 bis 0,174
rein 0,172 ; einachsig negativ |
| Optischer Achsenwinkel | 2V = kann anomal zweiachsig auftreten
2Vx dann 4-14° (bis 25°) |
| Pleochroismus | nicht vorhanden |
| Weitere Eigenschaften | |
| Chemisches Verhalten | in kalten, verdünnten Säuren unter heftigem Brausen löslich |
| Ähnliche Minerale | Aragonit, Dolomit |
| Besondere Kennzeichen | sehr starke Doppelbrechung; gelegentlich Fluoreszenz in rot oder orange; häufige Zwillingslamellen |
Calcit, auch Kalzit oder Kalkspat, ist ein sehr häufig vorkommendes Mineral und Namensgeber der Calcitgruppe innerhalb der Mineralklasse der „Carbonate (und Verwandte)“. Es kristallisiert im trigonalen Kristallsystem mit der chemischen Zusammensetzung Ca[CO3] und entwickelt verschiedene Kristall- beziehungsweise Aggregatformen (Habitus), die entweder farblos oder von milchig weißer bis grauer, durch Verunreinigungen auch gelber, rosa, roter, blauer, grüner, brauner oder schwarzer Farbe sein können.
Mit einer Mohshärte von 3 gehört Calcit zu den weichen Mineralen und dient als Bezugsgröße auf der bis 10 (Diamant) reichenden Skala nach Friedrich Mohs.
Besondere Eigenschaften

Charakteristisch für Calcitkristalle ist eine besonders hohe Doppelbrechung. Licht, das nicht entlang der optischen Achse des Kristalls einfällt, wird in zwei Lichtbündel aufgespalten, einen ordentlichen und einen außerordentlichen Strahl. Für diese beiden Strahlen gelten auf Grund unterschiedlicher Polarisationsrichtungen andere Brechungsindizes. Dies zeigt sich darin, dass bei einem bestimmten Blickwinkel jedes durch einen klaren Kristall beobachtete Objekt doppelt erscheint, eine zur Identifikation von Calcit sehr hilfreiche Eigenschaft, daher auch der häufige Name Doppelspat. In Island, dem bekanntesten Vorkommen für Doppelspat, wird er als silfurberg (Silberfels) bezeichnet. Er wird aufgrund dieser Eigenschaft auch als anisotrop beschrieben.
Verglichen mit anderen Mineralen ist Calcit kaum resistent gegenüber der Verwitterung. Er ist viel weicher als Quarz oder Feldspat und bereits in saurem Wasser löslich. In kalten, verdünnten Säuren löst sich Calcit unter heftiger Gasentwicklung auf.
Je nach Fundort kann Calcit durch Einlagerung von Seltenen Erden[2] unter UV-Licht rot, blau oder gelb, aber auch andersfarbig fluoreszieren. Des Weiteren sind auch phosphoreszierende, kathodolumineszierende, thermolumineszierende und selten auch tribolumineszierende Calcite möglich.[3]
Etymologie und Geschichte
Der Name Calcit leitet sich aus dem griechischen χάλιξ chálix (m und f; „Mörtel, Kalk, Kies“) beziehungsweise lateinischen calx ab, was jeweils Kalk bedeutet.
Klassifikation
In der mittlerweile veralteten, aber noch gebräuchlichen 8. Auflage der Mineralsystematik nach Strunz gehörte der Calcit zur Mineralklasse der „Carbonate, Nitrate und Borate“ und dort zur Abteilung der „Wasserfreien Carbonate ohne fremde Anionen“, wo er als namensgebendes Mineral die „Calcitgruppe“ mit der System-Nr. V/B.02 und den weiteren Mitgliedern Gaspéit, Magnesit, Otavit, Rhodochrosit, Siderit, Smithsonit, Sphärocobaltit und Vaterit bildete.
Die seit 2001 gültige und von der International Mineralogical Association (IMA) verwendete 9. Auflage der Strunz'schen Mineralsystematik ordnet den Calcit in die Klasse der „Carbonate und Nitrate“ (die Borate bilden jetzt eine eigene Klasse) und dort in die Abteilung der „Carbonate ohne weitere Anionen, ohne H2O“ ein. Diese Abteilung ist allerdings weiter unterteilt nach der Elementgruppenzugehörigkeit der beteiligten Kationen, so dass das Mineral entsprechend seiner Zusammensetzung in der Unterabteilung „Erdalkali- (und andere M2+) Carbonate“ zu finden ist, wo es die nach wie vor existierende „Calcitgruppe“ mit der System-Nr. 5.AB.05 bildet. Der Vaterit gehört allerdings nicht mehr dazu, da er jetzt eine eigene Gruppe bildet.
Die vorwiegend im englischen Sprachraum gebräuchliche Systematik der Minerale nach Dana ordnet den Calcit wie die veraltete Strunz-Systematik in die gemeinsame Klasse der „Carbonate, Nitrate und Borate“ und dort in die Abteilung der „Wasserfreien Carbonate“ ein. Hier ist er ebenfalls Namensgeber der „Calcitgruppe (Trigonal: R-3c)“ mit der System-Nr. 14.01.01 und den weiteren Mitgliedern Gaspéit, Magnesit, Otavit, Rhodochrosit, Siderit, Smithsonit und Sphaerocobaltit innerhalb der Unterabteilung „14.01 Wasserfreie Carbonate mit einfacher Formel A+CO3“.
Modifikationen und Varietäten
Chemisch gesehen ist Calcit, wie der ähnliche Aragonit und der Vaterit, ein Calciumcarbonat, also ein Calcium-Salz der Kohlensäure.
Als Blätterspat oder auch Papierspat werden Calcitvarietäten mit dünnen, blätterartigen Kristallen bezeichnet.
Kanonenspat ist eine Calcitvarietät mit langsäulig gestrecktem, pseudohexagonalem Habitus.[4] Als Manganocalcit wird eine manganhaltige Varietät des Calcit bezeichnet.[5]
Bildung und Fundorte

Gebildet wird Calcit nach dem chemischen Gleichgewicht:
- $ \mathrm {Ca} ^{2+}+2\mathrm {HCO} _{3}^{-}\quad {\overrightarrow {\leftarrow }}\quad \mathrm {CaCO} _{3}+\mathrm {H} _{2}\mathrm {O} +\mathrm {CO} _{2} $
Das Gleichgewicht der obigen Reaktion verlagert sich mit steigender Temperatur zunehmend auf die rechte Seite. In warmen Gewässern können Lebewesen also mit geringerem Energieaufwand Kalkgehäuse bilden. In Dampfkesseln und anderen Gefäßen, in welchen kalkhaltiges Wasser erhitzt wird, entsteht auf diese Weise Kesselstein.
Calcit kann sowohl massiv als auch körnig, faserig oder kristallin auftreten und zeigt in letzterem Falle den höchsten Formenreichtum aller Minerale. Es ist als Gestein bildendes Mineral eines der häufigsten der Erdkruste und kommt sowohl in magmatischen Gesteinen, zum Beispiel in Karbonatiten, in metamorphen Gesteinen (Marmor) oder Sedimentgesteinen wie Kalkstein vor. Es tritt alleine oder mit anderen Mineralen vergesellschaftet in Gängen auf, entsteht aber auch an der Erdoberfläche. Häufig entstand/entsteht Calcit durch Biomineralisation, sei es in Gesteinsformationen, im Boden, als in Teilen unerwünschter Zahnbelag (neben bevorzugt Calcium-Hydroxylapatit) usw.; hier aber immer in ganz bestimmten Mikro-Umweltbedingungen (Schmittner und Giresse, 1999).
Calcit löst sich gut in säurehaltigem Wasser und wird dadurch leicht zum Beispiel aus Kalkstein ausgelaugt, wodurch Höhlensysteme entstehen. Der gelöste Calcit lagert sich an anderer Stelle wieder ab. Dabei entstehen die für Tropfsteinhöhlen typischen Tropfsteine, die Stalagmiten und Stalaktiten.
Die weitaus größten Calcitvorkommen gehen auf Meeresablagerungen zurück. Dabei setzen sich die calcithaltigen Skelette und Schalen unzähliger kleiner Meerestiere wie etwa Muscheln, Korallen und diverser Protisten wie die Coccolithophoriden am Meeresgrund ab. Diese Kalkalgen werden mit einer Größe von weniger als 30 Mikrometern zum Nanoplankton gezählt und bilden winzige Kalkschilde, die so genannten Coccolithen, die nach dem Absterben der Algen auf den Ozeanboden sinken. Beispielsweise bestehen die Kreidefelsen von Dover aus solchen Coccolithen. Auch Korallenriffe spielen bei der Calcitbildung eine herausragende Rolle.
Anorganische, abiogene Bildungsbereiche von Calcit sind flache, im Intertidalbereich gelegene, tropische Meeresplattformen. Dort wird Calcit in Form von millimeterkleinen Kügelchen (Kalkooiden) ausgefällt. Calcit in Marmor geht auf thermische Metamorphose von Calcitsedimenten zurück.
Ab einer Meerestiefe von 3500 Metern, der so genannten Calcit-Kompensationstiefe, löst sich Calcit vollständig in Wasser. Daher bleiben in dieser Tiefe weder calcithaltige Sedimente noch Muschelschalen oder Skelette erhalten.
Des Weiteren kommt Calcit als Einlagerung in die Statolithenmembran der Makulaorgane des Innenohres vor. Es spielt dort eine große Rolle bei der Wahrnehmung von Beschleunigungen und der Lotrichtung – siehe Gleichgewichtsorgan.
Bekannt aufgrund außergewöhnlicher Calcitfunde ist vor allem Island, wo neben dem bekannten, wasserklaren Doppelspat auch die bisher größten Kristalle gefunden wurden. Am Helgustadir nahe Reyðarfjörður hatte der größte Kristall eine Abmessungen von 7 m × 7 m × 2 m und der schwerste ein Gewicht von 280 t.[6] In der „Sterling Bush“-Höhle im Lewis County (New York) trat ein Calcit-Rhomboeder von 109 cm × 95 cm × 46 cm und einem Gewicht von rund 500 kg zutage.[7]
Einer der größten im Museum ausgestellten Calcite befindet sich im Natural History Museum mit einem Gewicht von 230 kg.[8]
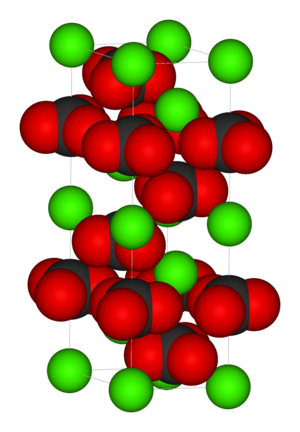
Kristallstruktur
Calcit kristallisiert trigonal in der Raumgruppe R 3 c (Raumgruppen-Nr. 167) mit den Gitterparametern a = 4,99 Å und c = 17,06 Å sowie 6 Formeleinheiten pro Elementarzelle.[9]
Verwendung
als Rohstoff
Der calcithaltige Marmor, Kalkstein und Onyxmarmor ist ein hochwertiges Dekorations- und Baumaterial, daneben wird Calcit in Kalkstein zur Produktion von Zement und Kunstdünger und als Zuschlagstoff bei der Verhüttung von Erzen eingesetzt. Besonders reine Kristalle finden wegen ihrer optischen Eigenschaften Verwendung in der optischen Industrie, insbesondere in der Polarisationsoptik, beispielsweise in Form von Glan-Taylor-Prismen oder als Verzögerungsplatte. Außerdem wird es in sauren, rutilumhüllten und basischen Elektroden als Schutzgasbildner beim Lichtbogenhandschweißen eingesetzt.
als Schmuckstein
Calcit ist für eine kommerzielle Verarbeitung als Schmuckstein eigentlich zu weich. Gelegentlich wird er aber dennoch im Glattschliff als Cabochon oder Trommelstein angeboten. Versierten Sammlern gelingt es darüber hinaus auch, Calcit in Facettenform zu bringen.[10]
als Terrariensand
Aufgrund der Säurelöslichkeit wird Calcit in Form von „Caltrat“ in Terrarien eingesetzt. Terrarientiere, die auf herkömmlichen (unverdaulichen) Fluss- und/oder Quarzsanden gehalten worden waren, litten nach der Aufnahme dieser Sande an oft tödlich verlaufenden Verstopfungen. Durch die Verwendung von (verdaulichem) Caltrat wird diese Gefahr weitgehend ausgeschlossen.
als Kompass
Doppelspat-Kristalle wurden möglicherweise in der Seefahrt zur Navigation benutzt (Sonnenstein), da seine besondere Eigenschaften eine genaue Bestimmung der Sonnenposition bei bedeckten Himmel ermöglichte.[11][12][13]
Siehe auch
Einzelnachweise
- ↑ Thompson, D.W. et al 1998. Determination of optical anisotropy in calcite from ultraviolet to mid-infrared by generalized ellipsometry. Thin Solid Films 313–314 (1998) S. 341–346; doi:10.1016/S0040-6090(97)00843-2.
- ↑ Hans Jürgen Rösler: Lehrbuch der Mineralogie. 4. durchgesehene und erweiterte Auflage. Deutscher Verlag für Grundstoffindustrie (VEB), Leipzig 1979, ISBN 3-342-00288-3, S. 695.
- ↑ John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols: Calcite, in: Handbook of Mineralogy, Mineralogical Society of America, 2001 (PDF 66,2 kB)
- ↑ Mineralienatlas:Kanonenspat
- ↑ Mineralienatlas:Manganocalcit
- ↑ Mineralienatlas:Mineralrekorde
- ↑ American Mineralogist - The largest crystal
- ↑ Isländischer Spat Calcit
- ↑ Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. 9. Auflage. E. Schweizerbart'sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 286.
- ↑ Walter Schumann: Edelsteine und Schmucksteine. 13. Auflage. BLV Verlags GmbH, 1976/1989, ISBN 3-405-16332-3 (S. 224)
- ↑ http://www.scinexx.de/wissen-aktuell-14056-2011-11-02.html
- ↑ http://rspa.royalsocietypublishing.org/content/early/2011/10/28/rspa.2011.0369
- ↑ http://www.spiegel.de/wissenschaft/technik/0,1518,795396,00.html
Literatur
- Martin Okrusch, Siegfried Matthes: Mineralogie: Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 7. Auflage. Springer, Berlin/Heidelberg/New York 2005. ISBN 3-540-23812-3
- Petr Korbel, Milan Novák: Mineralien Enzyklopädie. Nebel, Eggolsheim 2002, ISBN 3-89555-076-0
- W. E. Tröger, H.U. Bambauer, F. Taborszky und H. D. Trochim: Optische Bestimmung gesteinsbildender Minerale, Teil 1: Bestimmungstabellen. Schweizerbart, Stuttgart 1981
- Karl-Erich Schmittner, Pierre Giresse: Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils. Roussillon, France 1999. In: Sedimentology 46/3: 463-476.
Weblinks
- Mineralienatlas:Calcit (Wiki)
- Isländischer Spat Calcit
- Chinesische Riesencalcite
- Webmineral (engl.)
- MinDat - Calcite (engl.)